题目内容
2.下列有关Na2S溶液的叙述正确的是( )| A. | 该溶液中,SO2、Cl- K+、HCO3-可以大量共存 | |
| B. | 和FeCl3溶液反应的离子方程式:S2-+Fe3+═Fe2++S | |
| C. | 和少量盐酸反应的离子方程式:S2-+H+═HS- | |
| D. | 1L0.1mol•L-1该溶液和足量硫酸铜溶液反应生成16.0克Cu2S |
分析 A.SO2、HCO3-发生强酸制取弱酸的反应;
B.发生氧化还原反应生成FeS和S;
C.硫化钠与少量盐酸反应生成NaHS;
D.反应生成CuS沉淀.
解答 解:A.SO2、HCO3-发生强酸制取弱酸的反应,则该组离子不能大量共存,故A错误;
B.发生氧化还原反应生成FeS和S,离子反应为3S2-+2Fe3+═2FeS↓+S,故B错误;
C.硫化钠与少量盐酸反应生成NaHS,离子反应为S2-+H+═HS-,故C正确;
D.反应生成CuS沉淀,由S原子守恒可知生成0.1molCuS,其质量为9.6g,故D错误;
故选C.
点评 本题考查较综合,涉及离子共存、离子反应及化学反应计算等,为高频考点,把握习题中的信息及氧化还原反应、与量有关的反应等为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.

练习册系列答案
相关题目
13.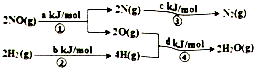 用H2可将工业废气中的NO催化还原化N2,其能量转化关系如图:(图中计量单位为mol),则:NO(g)+H2(g)═0.5N2(g)+H2O(g)的△H为( )
用H2可将工业废气中的NO催化还原化N2,其能量转化关系如图:(图中计量单位为mol),则:NO(g)+H2(g)═0.5N2(g)+H2O(g)的△H为( )
 用H2可将工业废气中的NO催化还原化N2,其能量转化关系如图:(图中计量单位为mol),则:NO(g)+H2(g)═0.5N2(g)+H2O(g)的△H为( )
用H2可将工业废气中的NO催化还原化N2,其能量转化关系如图:(图中计量单位为mol),则:NO(g)+H2(g)═0.5N2(g)+H2O(g)的△H为( )| A. | 0.5•(a+b-c-d)kJ/mol | B. | 0.5•(c+a-d-b)kJ/mol | ||
| C. | 0.5•(c+d-a-b)kJ/mol | D. | 0.5•(c+d-a-b)kJ/mol |
17.一定体积某浓度的SnC12溶液与过量FeC13溶液充分混合后,再用0.2000mol/l K2Cr2O7标准溶液滴定.若所需K2Cr2O7溶液的体积恰好是SnCl2溶液的一半,则c(SnC12)为( )
| A. | 0.3000 mol/L | B. | 1.2000 mol/L | C. | 0.0333 mol/L | D. | 0.1333 mol/L |
7.空气的成分中,体积分数约占 78%的是( )
| A. | 氮气 | B. | 氧气 | C. | 二氧化碳 | D. | 稀有气体 |
14.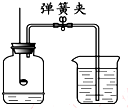 如图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号.下列说法中,不正确的是( )
如图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号.下列说法中,不正确的是( )
 如图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号.下列说法中,不正确的是( )
如图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号.下列说法中,不正确的是( )| A. | 实验时红磷一定过量 | |
| B. | 点燃红磷前先用弹簧夹夹紧乳胶管 | |
| C. | 红磷熄灭后立刻打开弹簧夹 | |
| D. | 最终进入瓶中水的体积约为氧气的体积 |
11.下列物质的转化在给定条件下能实现的是( )
| A. | H2SO4(稀)$→_{△}^{Cu}$SO2$\stackrel{少量氨水}{→}$NH4HSO3$\stackrel{足量氨水}{→}$(NH4)2SO3 | |
| B. | NH3$→_{催化剂△}^{O_{2}}$NO$\stackrel{O_{2}}{→}$NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| C. | Fe$→_{△}^{少量Cl_{2}}$FeCl2$\stackrel{NaOH溶液}{→}$Fe(OH)2$\stackrel{空气中放置}{→}$Fe(OH)3 | |
| D. | Al$\stackrel{NaOH溶液}{→}$NaAlO2$\stackrel{足量盐酸}{→}$AlCl3溶液$\stackrel{△}{→}$无水AlCl3 |
12.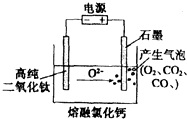 如图为EFC剑桥法用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔融盐,阴极最后只剩下纯钛.下列说法中正确的是( )
如图为EFC剑桥法用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔融盐,阴极最后只剩下纯钛.下列说法中正确的是( )
 如图为EFC剑桥法用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔融盐,阴极最后只剩下纯钛.下列说法中正确的是( )
如图为EFC剑桥法用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔融盐,阴极最后只剩下纯钛.下列说法中正确的是( )| A. | 阳极的电极反应式为:2Cl--2e-=Cl2↑ | |
| B. | 通电后,O2-、Cl-均向阴极移动 | |
| C. | 阴极的电极反应式为TiO2+4e-=Ti+2O2- | |
| D. | 石墨电极的质量不发生变化 |
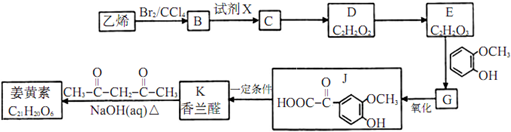

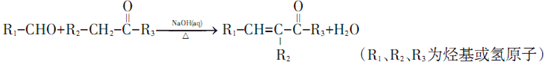
 ;
; ;其反应类型是加成反应;
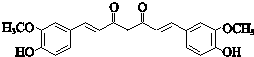
;其反应类型是加成反应;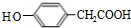 (写结构简式).
(写结构简式).