题目内容
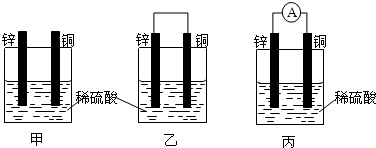
5.下列叙述是小明做完铜、锌原电池的实验后得出的结论和认识,你认为正确的是( )| A. | 构成原电池正极和负极的材料必须是两种活泼性不同的金属 | |
| B. | 由铜、锌作电极与硫酸铜溶液组成的原电池中铜是负极 | |
| C. | 电子沿外导线由锌流向铜,内电路中电子通过稀硫酸被H+得到而放出氢气 | |
| D. | 铜锌原电池工作时,若有13 g锌被溶解,电路中就有0.4 mol电子通过 |
分析 A.构成原电池正负极的材料不一定都是金属;
B.原电池中,易失电子的金属作负极;
C.原电池放电时,内电路是离子的定向移动,阴离子向负极移动;
D.根据锌和转移电子之间的关系式计算.
解答 解:A.构成原电池正负极的材料不一定都是金属,如锌、石墨和稀硫酸也能构成原电池,故A错误;
B.原电池中,易失电子的金属作负极,所以由铜锌作为电极与硫酸铜溶液组成的原电池中,Zn是负极,故B错误;
C.原电池放电时,内电路是离子的定向移动,氢离子在正极表面得电子生成氢气,故C错误;
D.负极电极反应为Zn-2e-=Zn2+,根据锌和转移电子关系得转移电子的物质的量=$\frac{13g}{65g/mol}×2$=0.4mol,故D正确;
故选D.
点评 本题考查了原电池原理,根据得失电子判断正负极,知道原电池构成条件及各个物理量之间的关系即可解答,注意电解质溶液中阴阳离子移动方向,为易错点.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
15.设NA为阿伏加德罗常数,下列叙述中正确的是( )
| A. | 常温常压下,2.24L 氯气与氢氧化钠溶液完全反应转移的电子数为0.1NA | |
| B. | 标准状况下,1L辛烷完全燃烧后,所生成气体产物的分子数为8NA/22.4 | |
| C. | 0.1L 2mol•L-1的(NH4)2S溶液中含有的S2-数目为0.2 NA | |
| D. | 在含有4mol Si-O键的石英晶体中,氧原子的数目为2NA |
16.下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是( )
| X | Y | Z | |
| ① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
| ② | KOH溶液 | SiO2 | 浓盐酸 |
| ③ | O2 | N2 | H2 |
| ④ | FeCl3溶液 | Cu | 浓硝酸 |
| A. | ①③ | B. | ①④ | C. | ②④ | D. | ②③ |
20.若NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 20g重水(2H2O)含有10NA个电子 | |
| B. | 常温常压下,1摩氦气含有2NA个原子 | |
| C. | 100mL 1mol/L NaHCO3 溶液含有0.1NA个HCO3- | |
| D. | 5.6g金属铁与足量稀盐酸反应完全反应时,失去 0.3NA个电子 |
10.能正确表示下列反应的离子方程式为( )
| A. | 向Fe(NO3)2稀溶液中加入稀盐酸:Fe2++2H++NO3-═Fe3++NO2↑+H2O | |
| B. | 向NaHSO4溶液中加入过量的Ba(OH)2溶液:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| C. | 向(NH4)2Mg(SO4)2溶液中加入少量的Na2O:Mg2++Na2O+H2O═Mg(OH)2↓+2Na+ | |
| D. | 向0.1mol•L-1、pH=1的NaHA溶液中加入NaOH溶液:HA-+OH-═A2-+H2O |
15.有铜和氧化铁的混合物a g,当慢慢滴入2mol/L的HCl溶液、边滴边振荡,至50mL时混合物恰好完全溶解.若将a g该混合物在CO气流中加热并充分反应,冷却后剩余固体中铜的质量可能为( )
| A. | 等于(a-0.8 )g | B. | 大于(a-0.8 )g | C. | 大于(a-2.67)g | D. | 等于(a-2.67)g |
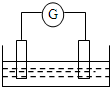 如图是常见原电池装置,电流表G发生偏转:
如图是常见原电池装置,电流表G发生偏转: