题目内容
16.下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是( )| X | Y | Z | |
| ① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
| ② | KOH溶液 | SiO2 | 浓盐酸 |
| ③ | O2 | N2 | H2 |
| ④ | FeCl3溶液 | Cu | 浓硝酸 |
| A. | ①③ | B. | ①④ | C. | ②④ | D. | ②③ |
分析 ①.氢氧化铝是两性氢氧化物和硫酸酸、氢氧化钠都发生反应,酸碱发生中和反应;
②.二氧化硅和氢氧化钠溶液反应,和浓盐酸不反应,浓盐酸和氢氧化钠溶液发生中和反应;
③.氧气和氮气、氢气都反应,氮气和氢气也可以发生反应;
④.铜和FeCl3溶液、浓硝酸都反应,FeCl3溶液和浓硝酸不发生反应.
解答 解:①.氢氧化铝是两性氢氧化物和硫酸酸、氢氧化钠都发生反应,酸碱发生中和反应,满足组内任意两种物质在一定条件下均能发生反应,故不选;
②.二氧化硅和氢氧化钠溶液反应生成硅酸钠和水,二氧化硅和浓盐酸不反应,浓盐酸和氢氧化钠溶液发生中和反应生成氯化钠和水,不满足组内任意两种物质在一定条件下均能发生反应,故选;
③.氧气和氮气在放电条件下生成NO,氧气和氢气在点燃的条件下反应生成水,氮气和氢气在高温高压催化剂条件下反应生成氨气,满足组内任意两种物质在一定条件下均能发生反应,故不选;
④.铜和FeCl3溶液反应生成氯化铜和氯化亚铁,铜与浓硝酸反应生成硝酸铜、二氧化氮和水,但FeCl3溶液和浓硝酸不发生反应,不满足组内任意两种物质在一定条件下均能发生反应,故选;
故选C.
点评 本题考查考查物质之间的反应,把握常见物质的性质及发生的化学反应为解答的关键,注意某些反应与量有关,明确性质与反应的关系即可解答,题目难度不大.

练习册系列答案
相关题目
7.某种分子的球棍模型如图所示(图中球与球之间的连线可代表单键、双键、叁键等):不同形式的球代表不同的原子,对该物质的判断正确的是( )
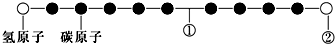

| A. | ①处的化学键是碳碳双键 | |
| B. | ②处的原子可能是氯原子 | |
| C. | 该分子中的原子不可能均在同一直线上 | |
| D. | 该分子不存在链状同分异构体 |
4.一定量的钠、铝合金置于水中,合金全部溶解,得到20ml、pH=14的溶液.然后用1mol/L的盐酸滴定至沉淀量最大时,消耗盐酸40ml.原合金中钠的质量为( )
| A. | 0.92g | B. | 0.69g | C. | 0.64g | D. | 0.23g |
11.NA表示阿伏加德罗常数.下列说法正确的是( )
| A. | 5.6g铁粉在0.1 mol氯气中充分燃烧,失去的电子数为0.3NA | |
| B. | 标准状况下,2.24 L CHCl3的分子数为0.1NA | |
| C. | 1L0.1mol/L Al2(SO4)3溶液中,Al3+的数目为0.2NA | |
| D. | 9.2gNO2和N2O4的混合气体中含有的氮原子数为0.2NA |
1.反应 3A(g)?2B(g)+D(g)在四种不同条件下进行,B、D的起始浓度为0.反应物A 的浓度 c 随时间 t 的变化情况如表:
根据上述数据,完成下列填空:
(1)在实验 1,反应在10min~20min 内D的平均速率为0.01 mol/(L•min)
(2)在实验 2,A 的初始浓度 c2=2.0 mol/L,反应经20min 就达到平衡,可推测实验2中还隐含的条件是加入正催化剂
(3)设实验 3、1平衡时的反应速率为 v3、v1,则 v3>v1(填<、>或=),且c3=2.5 mol/L
(4)推测正反应是放热反应(填吸热或放热).理由是从实验1到实验4,温度升高,A的平衡浓度升高,说明升温平衡向逆反应方向移动,所以正反应为放热反应.
| 实验 序号 | 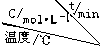 | 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 500 | 2.0 | 1.6 | 1.3 | 1.0 | 0.8 | 0.8 |
| 2 | 500 | c2 | 1.2 | 0.8 | 0.8 | 0.8 | 0.8 |
| 3 | 500 | c3 | 1.7 | 1.3 | 1.0 | 1.0 | 1.0 |
| 4 | 600 | 2.0 | 1.1 | 0.9 | 0.9 | 0.9 | 0.9 |
(1)在实验 1,反应在10min~20min 内D的平均速率为0.01 mol/(L•min)
(2)在实验 2,A 的初始浓度 c2=2.0 mol/L,反应经20min 就达到平衡,可推测实验2中还隐含的条件是加入正催化剂
(3)设实验 3、1平衡时的反应速率为 v3、v1,则 v3>v1(填<、>或=),且c3=2.5 mol/L
(4)推测正反应是放热反应(填吸热或放热).理由是从实验1到实验4,温度升高,A的平衡浓度升高,说明升温平衡向逆反应方向移动,所以正反应为放热反应.
8.如图五个图中,横坐标表示加入的物质的量,纵坐标表示生成沉淀的量,从A-E中选择各题要求的序号填入表
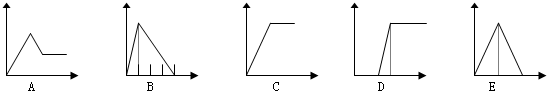

| 溶液 | 加入的物质 | 答案序号 |
| (1)饱和石灰水 | 通CO2至过量 | E |
| (2)AlCl3溶液 | 通过量的NH3 | C |
| (3)含少量HCl的AlCl3溶液 | 通过量的NH3 | D |
| (4)NaAlO2溶液 | 滴加稀HCl至过量 | B |
| (5)MgCl2 和AlCl3的混和液 | 滴加NaOH至过量 | A |
5.下列叙述是小明做完铜、锌原电池的实验后得出的结论和认识,你认为正确的是( )
| A. | 构成原电池正极和负极的材料必须是两种活泼性不同的金属 | |
| B. | 由铜、锌作电极与硫酸铜溶液组成的原电池中铜是负极 | |
| C. | 电子沿外导线由锌流向铜,内电路中电子通过稀硫酸被H+得到而放出氢气 | |
| D. | 铜锌原电池工作时,若有13 g锌被溶解,电路中就有0.4 mol电子通过 |
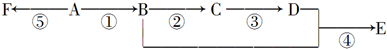
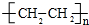 .
.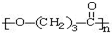 ),它可代替F,以减少“白色污染”. 聚丁内酯可用环丁内酯开环聚合而成,其工业生产方法和降解原理如下:
),它可代替F,以减少“白色污染”. 聚丁内酯可用环丁内酯开环聚合而成,其工业生产方法和降解原理如下: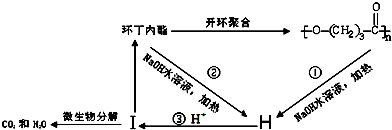
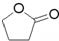 .
. .
.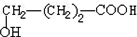 +9O2$\stackrel{微生物}{→}$8CO2↑+8H2O.
+9O2$\stackrel{微生物}{→}$8CO2↑+8H2O.