题目内容
20.若NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 20g重水(2H2O)含有10NA个电子 | |
| B. | 常温常压下,1摩氦气含有2NA个原子 | |
| C. | 100mL 1mol/L NaHCO3 溶液含有0.1NA个HCO3- | |
| D. | 5.6g金属铁与足量稀盐酸反应完全反应时,失去 0.3NA个电子 |
分析 A.根据n=$\frac{m}{M}$计算20g重水的物质的量,每个重水分子含有10个电子,据此计算电子物质的量,再根据N=nNA计算电子数目;
B.氦气为单原子分子;
C.碳酸氢根离子为多元弱酸的酸式根离子,溶液水后,部分发生水解;
D.铁与盐酸反应生成氯化亚铁,铁为+2价.
解答 解:A.20g重水的物质的量为$\frac{20g}{20g/mol}$=1mol,每个重水分子含有10个电子,含有电子物质的量为10mol,故含有电子数目为10mol×NAmol-1=10NA,故A正确;
B.氦气为单原子分子,1摩氦气含有NA个原子,故B错误;
C.碳酸氢根离子在水溶液中部分发生水解,100mL 1mol/L NaHCO3 溶液含有小于0.1NA个HCO3-,故C错误;
D.5.6g金属铁的物质的量为0.1mol,与足量稀盐酸反应生成氯化亚铁,失去 0.2NA个电子,故D错误;
故选:A.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确稀有气体为单原子分子,明确盐类水解的规律是解题关键,题目难度不大.

练习册系列答案
 综合自测系列答案
综合自测系列答案
相关题目
10.下列说法正确的是( )
| A. | 摩尔是表示物质粒子数量的单位 | B. | 物质的量可理解为物质的质量 | ||
| C. | 摩尔是表示物质的量的单位 | D. | 摩尔是七个基本物理量之一 |
11.NA表示阿伏加德罗常数.下列说法正确的是( )
| A. | 5.6g铁粉在0.1 mol氯气中充分燃烧,失去的电子数为0.3NA | |
| B. | 标准状况下,2.24 L CHCl3的分子数为0.1NA | |
| C. | 1L0.1mol/L Al2(SO4)3溶液中,Al3+的数目为0.2NA | |
| D. | 9.2gNO2和N2O4的混合气体中含有的氮原子数为0.2NA |
8.如图五个图中,横坐标表示加入的物质的量,纵坐标表示生成沉淀的量,从A-E中选择各题要求的序号填入表
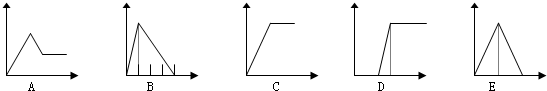

| 溶液 | 加入的物质 | 答案序号 |
| (1)饱和石灰水 | 通CO2至过量 | E |
| (2)AlCl3溶液 | 通过量的NH3 | C |
| (3)含少量HCl的AlCl3溶液 | 通过量的NH3 | D |
| (4)NaAlO2溶液 | 滴加稀HCl至过量 | B |
| (5)MgCl2 和AlCl3的混和液 | 滴加NaOH至过量 | A |
15.下列离子方程式书写正确的是( )
| A. | FeBr2溶液中通入少量Cl2:Fe2++Cl2═Fe3++2Cl- | |
| B. | 金属钠跟水反应2Na+2H2O═2Na++2OH-+H2↑ | |
| C. | 碳酸钡溶于醋酸BaCO3+2H+═Ba2++H2O+CO2↑ | |
| D. | 向NH4HSO4溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全Ba2++2OH-+NH4++H++SO42-═BaSO4↓+NH3•H2O+H2O |
5.下列叙述是小明做完铜、锌原电池的实验后得出的结论和认识,你认为正确的是( )
| A. | 构成原电池正极和负极的材料必须是两种活泼性不同的金属 | |
| B. | 由铜、锌作电极与硫酸铜溶液组成的原电池中铜是负极 | |
| C. | 电子沿外导线由锌流向铜,内电路中电子通过稀硫酸被H+得到而放出氢气 | |
| D. | 铜锌原电池工作时,若有13 g锌被溶解,电路中就有0.4 mol电子通过 |
12.元素R的质量数为A,Rn-的核外电子数为x,则ngRn-所含中子的物质的量为( )
| A. | (A-x+n)mol | B. | (A-x-n)mol | C. | (A-x+n)n/Amol | D. | (A-x-n)n/Amol |
9.填写下表
| 物质(杂质) | 除去杂质 所需试剂或方法 | 离子方程式(若无离子方程式,则写化学方程式) |
| Fe(Al) | ||
| CO2(HCl) | ||
| NaHCO3溶液(Na2CO3) | ||
| Al2O3(Al(OH)3) |
10.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下,11.2L 二氧化硫气体中含有0.5NA个SO2分子 | |
| B. | 常温下,3.2g硫与足量铁粉充分反应,转移的电子数为0.2 NA个 | |
| C. | 1 mol 苯分子中含有3 NA个碳碳双键 | |
| D. | 0.1mol•L-1的Na2S溶液中含有0.2NA个Na+离子 |