题目内容
17.已知2A(g)+B(g)?2C(g);△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为w mol/L,放出热量b kJ.(1)比较a>b( 填>、=、<)
(2)若在原来的容器中,只加入2mol C,500℃时充分反应达平衡后,吸收热量ckJ,C物质的浓度=(填>、=、<)w mol/L,a、b、c之间满足的关系式为a=b+c(用含a、b、c的代数式表示).
(3)能说明该反应已经达到平衡状态的是bc.
a、V(C)=2V(B); b、容器内压强保持不变
c、V逆(A)=2V正(B) d、容器内的密度保持不变
(4)若将上述容器改为恒压容器(反应前体积相同),起始时加入2molA和lmolB,500℃时充分反应达平衡后,放出热量d kJ,则d>b ( 填>、=、<).
分析 (1)可逆反应中反应物不能全部转化为生成物;
(2)若在原来的容器中,只加入2molC,全部转化为AB分别为2molA和1molB,则与原平衡时等效平衡,平衡时浓度相同;正向反应和逆向反应的转化率之和为100%
(3)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变,以此进行判断;
(4)恒压条件下,由于始终保持较大压强,转化的越多,放出热量较多.
解答 解:(1)已知2A(g)+B(g)?2C(g),△H=-a kJ•mol-1(a>0),该反应为可逆反应,可逆反应中反应物不能全部转化为生成物,则在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为wmol/L,则w<2,所以放出热量为小于akJ,即a>b;
故答案:>;
(2)若在原来的容器中,只加入2molC,全部转化为AB分别为2molA和1molB,则与原平衡时等效平衡,平衡时浓度相同,所以平衡时C的浓度等于wmol/L;正向反应和逆向反应的转化率之和为100%,则正向反应放热与逆向反应放热之和为a kJ,所以a=b+c;
故答案为:=;a=b+c;
(3)a.v(C)=2v (B),从反应开始平衡一直有这样的等量关系,所以不能作平衡状态的标志,故a不选;
b.容器内压强保持不变,说明总物质的量不变,正逆反应速率相等,故b选;
c.v逆(A)=2v逆(B)=2v正(B2),说明达平衡状态,故c选;
d.容器内的密度保持不变,从反应开始平衡一直有这样的等量关系,所以不能作平衡状态的标志,故d不选;
故选:bc;
(4)恒压条件下,由于始终保持较大压强,转化的越多,放出热量较多,则d>b,故答案为:>.
点评 本题考查等效平衡、反应热的计算、化学平衡状态的判断以及平衡的移动的知识等,题目综合性强,难度中等,注意把握等效平衡的原理.

 名校课堂系列答案
名校课堂系列答案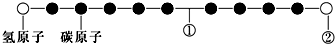
| A. | ①处的化学键是碳碳双键 | |
| B. | ②处的原子可能是氯原子 | |
| C. | 该分子中的原子不可能均在同一直线上 | |
| D. | 该分子不存在链状同分异构体 |
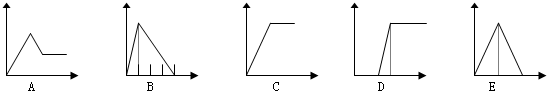
| 溶液 | 加入的物质 | 答案序号 |
| (1)饱和石灰水 | 通CO2至过量 | E |
| (2)AlCl3溶液 | 通过量的NH3 | C |
| (3)含少量HCl的AlCl3溶液 | 通过量的NH3 | D |
| (4)NaAlO2溶液 | 滴加稀HCl至过量 | B |
| (5)MgCl2 和AlCl3的混和液 | 滴加NaOH至过量 | A |
| A. | 构成原电池正极和负极的材料必须是两种活泼性不同的金属 | |
| B. | 由铜、锌作电极与硫酸铜溶液组成的原电池中铜是负极 | |
| C. | 电子沿外导线由锌流向铜,内电路中电子通过稀硫酸被H+得到而放出氢气 | |
| D. | 铜锌原电池工作时,若有13 g锌被溶解,电路中就有0.4 mol电子通过 |
| A. | (A-x+n)mol | B. | (A-x-n)mol | C. | (A-x+n)n/Amol | D. | (A-x-n)n/Amol |
| 物质(杂质) | 除去杂质 所需试剂或方法 | 离子方程式(若无离子方程式,则写化学方程式) |
| Fe(Al) | ||
| CO2(HCl) | ||
| NaHCO3溶液(Na2CO3) | ||
| Al2O3(Al(OH)3) |
 为了探究氯气和氯水的一些化学性质,某学生用如图所示装置进行有关实验,打开A的玻璃塞,将A中浓盐酸溶液逐滴加入装有二氧化锰的B中,试回答:
为了探究氯气和氯水的一些化学性质,某学生用如图所示装置进行有关实验,打开A的玻璃塞,将A中浓盐酸溶液逐滴加入装有二氧化锰的B中,试回答:
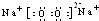 ;在反应②中,当生成2.24L的G(标准状况)时,反应转移的电子数目为0.2NA或1.024×1023.
;在反应②中,当生成2.24L的G(标准状况)时,反应转移的电子数目为0.2NA或1.024×1023.