题目内容
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:____。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按下图连接好装置进行实验。
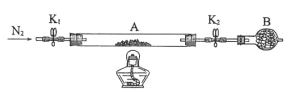
①仪器B的名称是____。
②将下列实验操作步骤正确排序____(填标号);重复上述操作步骤,直至A恒重,记为m3g。
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A
f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目x=____(列式表示)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
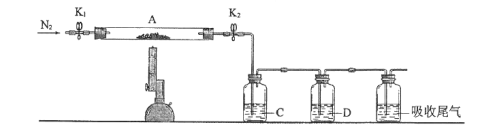
①C、D中的溶液依次为____(填标号)。C、D有气泡,并可观察到的现象分别为____。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式____。
【答案】样品中没有Fe3+,Fe2+易被氧化为Fe3+ 球形干燥管 dabfce ![]() c、a 生成白色沉淀、品红溶液褪色 2FeSO4
c、a 生成白色沉淀、品红溶液褪色 2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
【解析】
(1)根据Fe3+与SCN-反应溶液变红分析;
(2)①仪器B中装有固体干燥剂,所以B的名称为球形干燥管;
②装置应先通入N2,排净装置中的空气,再点燃酒精灯,开始反应,反应结束后先熄灭酒精灯,使装置冷却到室温后,再关闭K1和K2,进行称量。
③关系式法计算;
(3)该题中FeSO4分解后的红棕色的Fe2O3,由Fe元素化合价升高,可知S元素化合价必有降低,产物之一必为SO2,根据化合价升降守恒和原子守恒可推测另一产物为SO3,据此分析。
(1)溶液中先滴加KSCN溶液,溶液颜色无明显变化,说明绿矾样品中无Fe3+,硫酸亚铁与KSCN不反应;再向试管中通入空气,溶液逐渐变红,则溶液中有Fe3+生成,说明硫酸亚铁易被空气氧化为硫酸铁,Fe3+与KSCN反应,使溶液变红;
答案:样品中没有Fe3+,Fe2+易被氧化为Fe3+
(2)①仪器B中装有固体干燥剂,所以B的名称为球形干燥管;
答案:球形干燥管;
②装置应先通入N2,排净装置中的空气,再点燃酒精灯,开始反应,反应结束后先熄灭酒精灯,使装置冷却到室温后,再关闭K1和K2,进行称量。所以操作步骤顺序为dabfce;
答案:dabfce
③结晶水的数目为x,m3-m1为FeSO4的质量,m2-m3为结晶水的质量;
FeSO4·xH2O~FeSO4~xH2O
152 18x
m3-m1 m2-m3
解得x=![]() ;
;
答案: ![]()
(3)①C、D中均有气泡冒出,则C中溶液为BaCl2,吸收生成的SO3,有白色沉淀生成,而SO2气体不反应,D中溶液为品红溶液,遇到SO2气体会褪色;
答案:c、a 生成白色沉淀、品红溶液褪色
②该题中FeSO4分解后的红棕色的Fe2O3,由Fe元素化合价升高,可知S元素化合价必有降低,产物之一必为SO2,根据化合价升降守恒和原子守恒可推测另一产物为SO3;硫酸亚铁高温分解反应的化学方程式为2FeSO4![]() Fe2O3+SO2↑+SO3↑;
Fe2O3+SO2↑+SO3↑;
答案:2FeSO4![]() Fe2O3+SO2↑+SO3↑。
Fe2O3+SO2↑+SO3↑。

【题目】乙酰苯胺是一种具有退热镇痛作用的药物,可用苯胺和冰醋酸为原料来制备乙酰苯胺。
①化学原理为: (已知:苯胺易被氧化)
(已知:苯胺易被氧化)
②相关物质的物理常数
物质 | 相对分子质量 | 状态 | 熔点(℃) | 沸点(℃) | 溶解度(g) | |
水 | 乙醇 | |||||
苯胺 | 93 | 无色液体 | 6 | 184 | 3.42(20℃) | 任意比混溶 |
冰醋酸 | 60 | 无色液体 | 17 | 118 | 任意比混溶 | 任意比混溶 |
乙酰苯胺 | 135 | 白色片状固体 | 114 | 304 | 0.56(20℃)、3.45(50℃)、5.20(100℃) | 36.9(20℃) |
③制各乙酰苯胺的装置如图所示:韦氏分馏柱作用与原理类似于冷凝管。
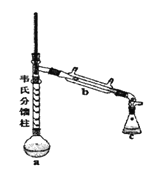
④制备方法和过程:

(1)仪器a的名称_______。
(2)制备过程中加入锌粒的作用:其一是________、其二是防止暴沸。
(3)从化学平衡的角度分析,步骤1要控制分馏柱上端的温度在105℃左右的原因_____。
(4)步骤2
(5)步骤3中洗涤剂最好选择________。
A.冷水 B.热水 C.15%的乙醇溶液 D.NaOH溶液
(6)步骤4重结晶的过程:粗产品溶于沸水中配成饱和溶液→再加入少量蒸馏水→加入活性炭脱色→加热煮沸→_____→冷却结晶→过滤→洗涤→干燥。
(7)本实验所得到的乙酰苯胺产率是________。