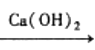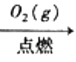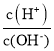题目内容
【题目】下列关于各图像的解释或结论正确的是( )
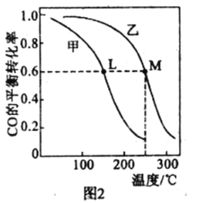
A.由甲可知:热化学方程式是H2(g)+![]() O2(g)=H2O(g)
O2(g)=H2O(g) ![]() H=-241.8kJ/mol
H=-241.8kJ/mol
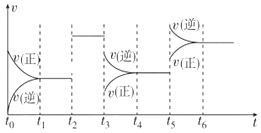
B.由乙可知:对于恒温恒容条件下的反应2NO2(g)![]() N2O4(g),A点为平衡状态
N2O4(g),A点为平衡状态
C.由丙可知:相同pH的盐酸和醋酸溶液分别加水稀释,b点溶液的导电性比c点溶液的导电性强
D.由丁可知:同温度、同物质的量浓度的HA溶液与HB溶液相比,其pH前者小于后者
【答案】CD
【解析】
A.图中的生成物是液态的,因此热化学方程式中的生成物也应该是液态的,A项错误;
B.A点只是二者消耗速率相等的点,根据计量数之比可以看出当![]() 和
和![]() 的消耗速率为2:1时,才是平衡状态,B项错误;
的消耗速率为2:1时,才是平衡状态,B项错误;
C.溶液的导电能力和离子浓度呈正比,一元酸电离出等量的![]() 和酸根离子,因此可以用
和酸根离子,因此可以用![]() 的浓度大小来判断导电能力强弱,则
的浓度大小来判断导电能力强弱,则![]() 浓度越小(pH越大)导电能力越弱,C项正确;
浓度越小(pH越大)导电能力越弱,C项正确;
D.从图象可以看出,加水稀释时,HA的pH变化大,故HA的酸性强于HB,因此同温度、同物质的量浓度的HA溶液与HB溶液相比,其pH前者小于后者,故D正确;
答案选CD。

 名校课堂系列答案
名校课堂系列答案【题目】用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2g含有少量中性易溶杂质的样品,配成500mL待测溶液。称量时,样品可放在___(填字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.2000mol·L-1的盐酸来滴定待测溶液,不可选用__(填字母)作指示剂。
A.甲基橙 B.石蕊 C.酚酞
(3)滴定过程中,眼睛应注视___。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是__mol·L-1,烧碱样品的纯度是___(保留两位数字)。
滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 4.10 | 24.00 |
(5)下列实验操作会对滴定结果产生什么后果?(填“偏高”“偏低”或“无影响”)
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果___。
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果___。