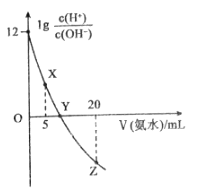
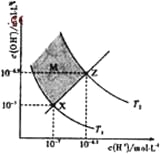
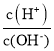题目内容
【题目】常温下,CH3COOH与NH3H2O的电离常数均为1.8×10-5。现向20mL浓度为0.1mol/LNH3H2O的溶液中滴加等物质的量浓度的CH3COOH溶液,所得混合液的导电率与加入CH3COOH溶液的体积(V)的关系如图所示。
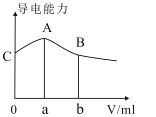
下列说法正确的是( )
A.a=20,A点溶液的pH=7
B.A、B两点中,B点溶液中水的电离程度最大
C.A点溶液中:c(CH3COO-)>c(NH4+)>c(H+)>c(OH-)
D.B、C两点中溶液的pH相等
【答案】A
【解析】
A.A点溶液导电性最大,CH3COOH与NH3H2O恰好完全反应,因此a=20,由于CH3COOH与NH3H2O的电离常数相等,A点显中性,溶液的pH=7,故A正确;
B.A点物质为醋酸铵,水的电离程度最大,B点CH3COOH过量,溶液显酸性,抑制水的电离,A点溶液中水的电离程度最大,故B错误;
C.A点溶液的pH=7,A点溶液中离子浓度大小关系为:c(CH3COO-)=c(NH4+)>c(H+)=c(OH-),故C错误;
D.C点溶液显碱性,B点溶液显酸性,两点溶液的pH不相等,故D错误;
答案选A。

【题目】氢叠氮酸(HN3)和莫尔盐[(NH4)2SO4·FeSO4·6H2O]是两种常用原料。
(1)氢叠氮酸易溶于水,25℃时,该酸的电离常数为Ka=10×10-5。
①氢叠氮酸在水溶液中的电离方程式为_______
②0.2mol/L的HN3溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃,此时,溶液呈酸性,则混合溶液中各离子和HN3分子浓度由大到小的顺序为_______。
(2)在FeSO4溶液中,加入(NH4)2SO4固体可制备莫尔盐晶体[(NH4)2Fe(SO4)2·6H2O],为了测定产品纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为cmol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如下:(已知莫尔盐的分子量为392)
实验次数 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液体积/mL | 25.52 | 25.02 | 24.98 |
①配制莫尔盐溶液,所使用的玻璃仪器除了烧杯和玻璃棒外还有_______
②滴定终点的现象是_______,通过实验数据,计算该产品的纯度为_______(用含字母a、c的式子表示)。
③上表第一次实验中记录数据明显大于后两次,其原因可能是_______。
A 第一次滴定时,锥形瓶用待装液润洗
B 该酸性高锰酸钾标准液保存时间过长,部分变质
C 滴定前酸式滴定管中尖嘴处有气泡,滴定结束后气泡消失