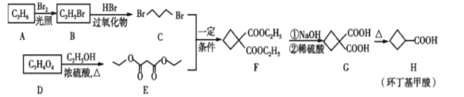
题目内容
【题目】著名化学家徐光宪在稀土化学等领域取得了卓越成就,被誉为“稀土界的袁隆平”。稀土元素包括钪、钇和镧系元素。请回答下列问题:
(1)写出基态二价钪离子(Sc2+)的核外电子排布式____,其中电子占据的轨道数为 ____。
(2)在用重量法测定镧系元素和使镧系元素分离时,总是使之先转换成草酸盐,然后经过灼烧而得其氧化物,如2LnCl3+3H2C2O4+nH2O=Ln2(C2O4)3nH2O+6HCl。
①H2C2O4中碳原子的杂化轨道类型为____;1 mol H2C2O4分子中含σ键和π键的数目之比为 ___。
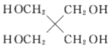
②H2O的VSEPR模型为 ___;写出与H2O互为等电子体的一种阴离子的化学式_______。
③HCI和H2O可以形成相对稳定的水合氢离子盐晶体,如HCl2H2O,HCl2H2O中含有H5O2+,结构为![]() ,在该离子中,存在的作用力有___________
,在该离子中,存在的作用力有___________
a.配位键 b.极性键 c.非极性键 d.离子键 e.金属键 f氢键 g.范德华力 h.π键 i.σ键
(3)表中列出了核电荷数为21~25的元素的最高正化合价:
元素名称 | 钪 | 钛 | 钒 | 铬 | 锰 |
元素符号 | Sc | Ti | V | Cr | Mn |
核电荷数 | 21 | 22 | 23 | 24 | 25 |
最高正价 | +3 | +4 | +5 | +6 | +7 |
对比上述五种元素原子的核外电子排布与元素的最高正化合价,你发现的规律是___________
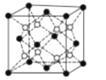
(4)PrO2(二氧化镨)的晶胞结构与CaF2相似,晶胞中Pr(镨)原子位于面心和顶点。假设相距最近的Pr原子与O原子之间的距离为a pm,则该晶体的密度为_____gcm-3(用NA表示阿伏加德罗常数的值,不必计算出结果)。
【答案】1s22s22p63s23p63d1 10 sp2杂化 7:2 四面体形 NH2- abfi 五种元素的最高正化合价数值等于各元素基态原子的最高能层s电子和次高能层d电子数目之和 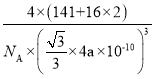
【解析】
(1)Sc(钪)为21号元素,1s22s22p63s23p63d14s2,据此写出基态Sc2+核外电子排布式;s、p、d能级分别含有1、3、5个轨道,基态Sc2+的核外电子3d轨道只占了一个轨道,据此计算Sc2+占据的轨道数;
(2)①根据杂化轨道理论进行分析;根据共价键的类型结合该分子的结构进行分析计算;
②根据价层电子对互斥理论分析H2O的分子空间构型;等电子体是原子数相同,电子数也相同的物质,据此写出与之为等电子体的阴离子;
③HCl2H2O中含有H5O2+,结构为![]() ,据此分析该粒子存在的作用力;
,据此分析该粒子存在的作用力;
(3)根据表中数据,分别写出Sc、Ti、V、Cr、Mn的外围电子排布式为:3d14s2、3d24s2、3d34s2、3d54s1、3d54s2,则有五种元素的最高正化合价数值等于各元素基态原子的最高能层s电子和次高能层d电子数目之和;
(4)根据均摊法进行计算该晶胞中所含粒子的数目,根据密度=![]() 进行计算。
进行计算。
(1)Sc(钪)为21号元素,基态Sc2+失去两个电子,其核外电子排布式为:1s22s22p63s23p63d1,s、p、d能级分别含有1、3、5个轨道,但基态Sc2+的核外电子3d轨道只占了一个轨道,故共占据1×3+3×2+1=10个,故答案为:1s22s22p63s23p63d1;10;
(2)①H2C2O4的结构式为![]() ,含碳氧双键,则碳原子的杂化轨道类型为sp2杂化,分子中含有7个σ键、2个π键,所以σ键和π键数目之比为:7:2,故答案为:sp2杂化;7:2;
,含碳氧双键,则碳原子的杂化轨道类型为sp2杂化,分子中含有7个σ键、2个π键,所以σ键和π键数目之比为:7:2,故答案为:sp2杂化;7:2;
②H2O中O原子的价层电子对数![]() ,且含有两个2个孤对电子,所以H2O的VSPER模型为四面体形,分子空间构型为V形,等电子体是原子数相同,电子数也相同的物质,因此,与H2O互为等电子体的阴离子可以是NH2-,故答案为:四面体形;NH2-;
,且含有两个2个孤对电子,所以H2O的VSPER模型为四面体形,分子空间构型为V形,等电子体是原子数相同,电子数也相同的物质,因此,与H2O互为等电子体的阴离子可以是NH2-,故答案为:四面体形;NH2-;
③HCl2H2O中含有H5O2+,结构为![]() ,存在的作用力有:配位键、极性键、氢键和σ键,故答案为:abfi;
,存在的作用力有:配位键、极性键、氢键和σ键,故答案为:abfi;
(3)根据表中数据,分别写出Sc、Ti、V、Cr、Mn的外围电子排布式为:3d14s2、3d24s2、3d34s2、3d54s1、3d54s2,则有五种元素的最高正化合价数值等于各元素基态原子的最高能层s电子和次高能层d电子数目之和,故答案为:五种元素的最高正化合价数值等于各元素基态原子的最高能层s电子和次高能层d电子数目之和;
(4)由图可知,相距最近的Pr原子和O原子之间的距离为该立方体晶胞的体对角线的![]() ,则该晶胞的晶胞参数
,则该晶胞的晶胞参数![]() ,每个晶胞中占有4个“PrO2”,则该晶胞的质量为
,每个晶胞中占有4个“PrO2”,则该晶胞的质量为![]() ,根据
,根据![]() 可得,该晶体的密度为:
可得,该晶体的密度为: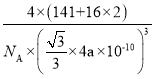 ,故答案为:
,故答案为: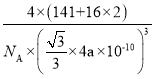 。
。

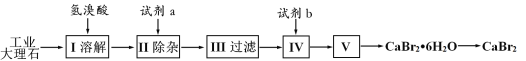
【题目】某科研小组用镍触媒废料(主要成分为Ni-Al合金,混有少量Fe、Cu、Zn及有机物) 制备NiO并回收金属资源的流程如下所示:
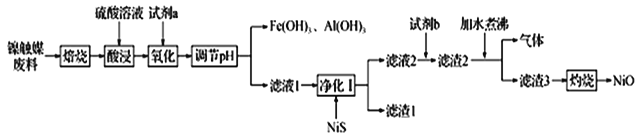
已知:相关数据如表1和表2所示
表1部分难溶电解质的溶度积常数(25℃)
物质 | Ksp | 物质 | Ksp |
Fe(OH)3 | 4.0×10-38 | CuS | 6.3×10-34 |
Fe(OH)2 | 1.8×10-16 | ZnS | 1.6×10-24 |
Al(OH)3 | 1.0×10-33 | NiS | 3.2×10-18 |
Ni(OH)2 | 2.0×10-15 |
表2 原料价格表
物质 | 价格/(元吨-1) |
漂液(含25.2%NaClO) | 450 |
双氧水(含30%H2O2) | 2400 |
烧碱(含98%NaOH) | 2100 |
纯碱(含99.5%Na2CO3) | 600 |
请回答下列问题:
(1)“焙烧”的目的是________________________________。
(2)“试剂a”的名称为__________________;选择该试剂的理由是______。
(3)“氧化”时反应的离子方程式为__________________________________________。
(4)欲使溶液中Fe3+和A13+的浓度均小于等于1.0×10-6 mol L-1,需“调节pH”至少为_______________。
(5)“试剂b”应选择__________,“加水煮沸”时,反应的化学方程式为_______________________________。
(6)氢镍电池是一种应用广泛的二次电池,放电时,该电池的总反应为NiOOH+MH=Ni(OH)2+M,当导线中流过2 mol电子时,理论上负极质量减少__________g。充电时的阳极反应式为_______________________________________________。