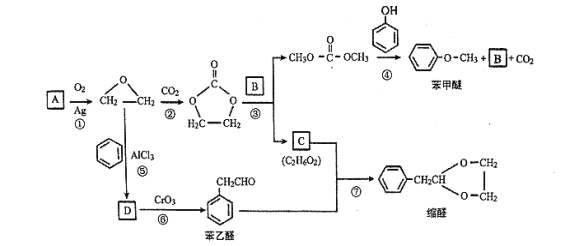
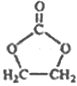
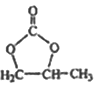
题目内容
【题目】某科研小组用镍触媒废料(主要成分为Ni-Al合金,混有少量Fe、Cu、Zn及有机物) 制备NiO并回收金属资源的流程如下所示:

已知:相关数据如表1和表2所示
表1部分难溶电解质的溶度积常数(25℃)
物质 | Ksp | 物质 | Ksp |
Fe(OH)3 | 4.0×10-38 | CuS | 6.3×10-34 |
Fe(OH)2 | 1.8×10-16 | ZnS | 1.6×10-24 |
Al(OH)3 | 1.0×10-33 | NiS | 3.2×10-18 |
Ni(OH)2 | 2.0×10-15 |
表2 原料价格表
物质 | 价格/(元吨-1) |
漂液(含25.2%NaClO) | 450 |
双氧水(含30%H2O2) | 2400 |
烧碱(含98%NaOH) | 2100 |
纯碱(含99.5%Na2CO3) | 600 |
请回答下列问题:
(1)“焙烧”的目的是________________________________。
(2)“试剂a”的名称为__________________;选择该试剂的理由是______。
(3)“氧化”时反应的离子方程式为__________________________________________。
(4)欲使溶液中Fe3+和A13+的浓度均小于等于1.0×10-6 mol L-1,需“调节pH”至少为_______________。
(5)“试剂b”应选择__________,“加水煮沸”时,反应的化学方程式为_______________________________。
(6)氢镍电池是一种应用广泛的二次电池,放电时,该电池的总反应为NiOOH+MH=Ni(OH)2+M,当导线中流过2 mol电子时,理论上负极质量减少__________g。充电时的阳极反应式为_______________________________________________。
【答案】除去废料中的有机物;使部分金属单质转化为氧化物 漂液 节约成本,不影响后续操作 2Fe2++ClO-+2H+=2 Fe3++Cl-+H2O 5 Na2CO3 NiCO3+H2O![]() Ni(OH)2+CO2↑ 2 Ni(OH)2+OH--e-=NiOOH +H2O
Ni(OH)2+CO2↑ 2 Ni(OH)2+OH--e-=NiOOH +H2O
【解析】
铁触媒废料焙烧,可以将部分金属单质转化为金属氧化物以及使有机物燃烧而除去,焙烧后固体和硫酸反应生成硫酸盐;再将Fe2+氧化成Fe3+,氧化剂选择漂液(因为漂液价格低廉,且不影响后续实验)。然后调节pH使Fe3+、Al3+一起转化为氢氧化物沉淀而除去。滤液1中还有Zn2+、Cu2+以及Ni2+,加入NiS,可以除去Zn2+、Cu2+。滤液2中有镍离子,同样的道理,在沉淀Ni2+的时候,选择碳酸钠,它的价格也是比较低,加入碳酸钠后得到碳酸镍;碳酸镍加水煮沸会转化成Ni(OH)2,最后Ni(OH)2灼烧分解,就可以得到氧化镍。
(1)焙烧可以使部分金属单质变成金属氧化物,并且能够使有机物燃烧并除去。所以“焙烧”的目的为:除去废料中的有机物;使部分金属单质转化为氧化物;
(2)应选择氧化剂使亚铁离子氧化成铁离子,氧化剂包括了漂液和双氧水,但是双氧水的价格更贵,所以选择漂液;选择漂液的理由就是漂液成本更低,而且生成NaCl也不影响后续操作。
(3)漂液中含有NaClO,将Fe2+氧化成Fe3+,ClO-被还原成Cl-,反应的离子方程式为![]() ;
;
(4)Fe(OH)3和Al(OH)3类型相同,Fe(OH)3 的Ksp比Al(OH)3小,为了使它们完全沉淀,用Al(OH)3的Ksp进行计算, 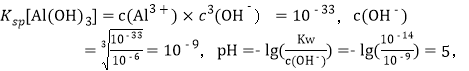 则pH至少为5;
则pH至少为5;
(5)需要选择沉淀Ni2+的沉淀剂,NaOH的价格更贵,所以选择Na2CO3,根据题意,加入Na2CO3时,生成的滤渣2为NiCO3,NiCO3加水煮沸转化成Ni(OH)2,加水煮沸的方程式为NiCO3+H2O![]() Ni(OH)2+CO2↑。
Ni(OH)2+CO2↑。
(6)镍氢电池放电时负极的是MH,在反应中MH变成了M,失去质量为H的质量,负极反应式为MH-e-+OH-=M+H2O,转移2mol,负极质量减少2g;充电时阳极发生氧化反应,化合价升高,Ni(OH)2变成NiOOH,电极反应式为:Ni(OH)2+OH--e-=NiOOH +H2O。

【题目】分析下表中各项的排布规律,按此规律排布第26项应为( )
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
C2H4 | C2H6 | C2H6O | C2H4O2 | C3H6 | C3H8 | C3H8O | C3H6O2 | C4H8 | C4H10 |
A. C7H16B. C7H14O2C. C8H18D. C8H18O