题目内容
【题目】为了探究铁、铜及其化合物的性质,某同学设计并进行了下列两组实验。
实验一:
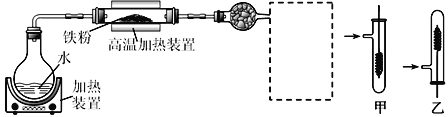
(1)写出在高温加热装置中发生的反应的化学方程式___________
(2)虚线框处宜选择的装置是_____(填“甲”或“乙”);实验时应先将螺旋状铜丝加热,变黑后再趁热迅速伸入所制得的纯净氢气中,观察到的实验现象是_________________。
(3)实验后,为检验硬质玻璃管中的固体是否含+3价的铁元素,该同学取一定量的固体并用一定浓度的盐酸溶解,滴加_________溶液(填试剂名称或化学式),没有出现血红色,说明该固体中没有+3价的铁元素。请你判断该同学的结论是否正确并说明理由________
实验二:绿矾是含有一定量结晶水的硫酸亚铁,为测定绿矾中结晶水含量,将石英玻璃管(带两端开关![]() 和
和![]() ,设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g,B为干燥管。按图连接好装置进行实验。
,设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g,B为干燥管。按图连接好装置进行实验。

实验步骤如下:(1)_______,(2)点燃酒精灯,加热,(3)________,(4)_______,(5)________,(6)称量A,重复上述操作步骤,直至A恒重,记为m3g。
(4)请将下列实验步骤的编号填写在对应步骤的横线上。
a. 关闭![]() 和
和![]() b. 熄灭酒精灯 c. 打开
b. 熄灭酒精灯 c. 打开![]() 和
和![]() 缓缓通入
缓缓通入![]() d. 冷却至室温
d. 冷却至室温
(5)必须要进行恒重操作的原因是_______________。
(6)已知在上述实验条件下,绿矾受热只是失去结晶水,硫酸亚铁本身不会分解,根据实验记录,计算绿矾化学式中结晶水数目X=____________(用含m1、m2、m3的列式表示)。
【答案】3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g) 乙 铜丝由黑变红 硫氰化钾或KSCN 不正确,因为铁过量时:Fe+2Fe3+=3Fe2+ c b d a 确保绿矾中的结晶水已全部失去
Fe3O4(s)+4H2(g) 乙 铜丝由黑变红 硫氰化钾或KSCN 不正确,因为铁过量时:Fe+2Fe3+=3Fe2+ c b d a 确保绿矾中的结晶水已全部失去 ![]()
【解析】
实验一:(1)在高温加热装置中发生的反应是铁和水蒸气的反应;
(2)铁和水蒸气反应生成的气体为氢气,氢气比空气轻;实验时应先将螺旋状铜丝加热,铜和氧气反应生成黑色的氧化铜,变黑后再趁热迅速伸入所制得的纯净氢气中,氢气还原氧化铜生成铜;
(3)检验铁离子的试剂可以选择KSCN溶液,遇到铁离子变血红色,铁和铁离子反应生成亚铁离子;
实验二:实验时,为避免亚铁被氧化,应先通入氮气,冷却时注意关闭开关,防止氧气进入,冷却至室温再称量固体质量的变化;
(4)实验步骤为:打开 K1 和 K2 缓缓通入 N2,点燃酒精灯,加热,熄灭酒精灯,冷却至室温,关闭 K1和 K2,称量A;
(5)为了使FeSO4晶体结晶水完全失去,保证测量结果更准确,需要进行恒重操作;
(6)直至A恒重,记为m3 g,应为FeSO4和装置的质量,则m(FeSO4)=(m3-m1)。m(H2O)=(m2-m3),以此计算n(H2O)、n(FeSO4),结晶水的数目等于![]() 。
。
(1)在高温加热装置中发生的反应是铁和水蒸气的反应,化学方程式是:3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g),故答案为:3Fe(s)+4H2O(g)
Fe3O4(s)+4H2(g),故答案为:3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g);
Fe3O4(s)+4H2(g);
(2)铁和水蒸气反应生成的气体为氢气,氢气比空气轻,所以虚线框处宜选择的装置是乙,实验时应先将螺旋状铜丝加热,铜和氧气反应生成黑色的氧化铜,变黑后再趁热迅速伸入所制得的纯净氢气中,氢气还原氧化铜生成铜,现象是铜丝由黑变为红色,
故答案为:乙;铜丝由黑变红;
(3)实验后,为检验硬质玻璃管中的固体是否含+3价的铁元素,该同学取一定量的固体并用一定浓度的盐酸溶解,滴加 KSCN溶液,没有出现血红色,不能说明该固体中没有+3价的铁元素,因为若铁过量会和生成的铁离子反应生成亚铁离子,Fe+2Fe3+=3Fe2+,没有出现血红色,不能说明该固体中没有+3价的铁元素,该同学的结论不正确,故答案为:硫氰化钾或KSCN;不正确,因为铁过量时:Fe+2Fe3+=3Fe2+;
(4)实验步骤为:打开 K1 和 K2 缓缓通入 N2,点燃酒精灯,加热,熄灭酒精灯,冷却至室温,关闭 K1和 K2,称量A,重复上述操作步骤,直至 A 恒重,记为m3 g,故答案为:c;b;d;a;
(5)只有FeSO4晶体中的结晶水完全失去,才能使测量结果更加准确,所以需要进行恒重操作,使两次称量的质量差小于0.1g,故答案为:确保绿矾中的结晶水已全部失去;
(6)直至A恒重,记为m3 g,应为FeSO4和装置的质量,则m(FeSO4)=(m3-m1),m(H2O)=(m2-m3),则n(H2O)=![]() 、n(FeSO4)=
、n(FeSO4)=![]() ,结晶水的数目等于
,结晶水的数目等于![]() =
=![]() =
=![]() ;故答案为:
;故答案为:![]() 。
。

【题目】著名化学家徐光宪在稀土化学等领域取得了卓越成就,被誉为“稀土界的袁隆平”。稀土元素包括钪、钇和镧系元素。请回答下列问题:
(1)写出基态二价钪离子(Sc2+)的核外电子排布式____,其中电子占据的轨道数为 ____。
(2)在用重量法测定镧系元素和使镧系元素分离时,总是使之先转换成草酸盐,然后经过灼烧而得其氧化物,如2LnCl3+3H2C2O4+nH2O=Ln2(C2O4)3nH2O+6HCl。
①H2C2O4中碳原子的杂化轨道类型为____;1 mol H2C2O4分子中含σ键和π键的数目之比为 ___。
②H2O的VSEPR模型为 ___;写出与H2O互为等电子体的一种阴离子的化学式_______。
③HCI和H2O可以形成相对稳定的水合氢离子盐晶体,如HCl2H2O,HCl2H2O中含有H5O2+,结构为![]() ,在该离子中,存在的作用力有___________
,在该离子中,存在的作用力有___________
a.配位键 b.极性键 c.非极性键 d.离子键 e.金属键 f氢键 g.范德华力 h.π键 i.σ键
(3)表中列出了核电荷数为21~25的元素的最高正化合价:
元素名称 | 钪 | 钛 | 钒 | 铬 | 锰 |
元素符号 | Sc | Ti | V | Cr | Mn |
核电荷数 | 21 | 22 | 23 | 24 | 25 |
最高正价 | +3 | +4 | +5 | +6 | +7 |
对比上述五种元素原子的核外电子排布与元素的最高正化合价,你发现的规律是___________
(4)PrO2(二氧化镨)的晶胞结构与CaF2相似,晶胞中Pr(镨)原子位于面心和顶点。假设相距最近的Pr原子与O原子之间的距离为a pm,则该晶体的密度为_____gcm-3(用NA表示阿伏加德罗常数的值,不必计算出结果)。
【题目】以环己醇为原料制取己二酸[HOOC(CH2)4COO H]的实验流程如下:
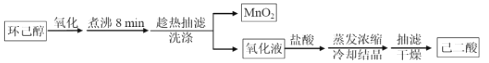
其中“氧化”的实验过程:在250mL四颈烧瓶中加入50 mL水和3.18g碳酸钠,低速搅拌至碳酸钠溶解,缓慢加入9.48g(约0.060 mol)高锰酸钾,按图示搭好装置:
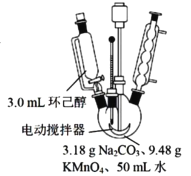
打开电动搅拌,加热至35℃,滴加3.2 mL(约 0.031 mol) 环己醇,发生的主要反应为:![]()
![]() KOOC(CH2)4COOK H<0
KOOC(CH2)4COOK H<0
(1)“氧化”过程应采用____________加热
(2)“氧化”过程为保证产品纯度需要控制环己醇滴速的原因是:_______________。
(3)为证明“氧化”反应已结束,在滤纸上点1滴混合物,若观察到___________则表明反应已经完成。
(4)“趁热抽滤”后,用___________进行洗涤(填“热水”或“冷水")。
(5)室温下,相关物质溶解度如表:
化学式 | 己二酸 | NaCl | KCl |
溶解度g/100g水 | 1.44 | 35.1 | 33.3 |
“蒸发浓缩”过程中,为保证产品纯度及产量,应浓缩溶液体积至_________(填标号)
A.5mL B.10mL C.15mL D.20mL
(6)称取己二酸(Mr-=146 g/mol)样品0.2920 g,用新煮沸的50 mL 热水溶解,滴入2滴酚酞试液,用0.2000 mol/L NaOH 溶液滴定至终点,消耗 NaOH 的平均体积为 19.70 mL。NaOH 溶液应装于____________(填仪器名称),己二酸样品的纯度为________。