题目内容
9.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.表列出了①~⑩九种元素在周期表中的位置.| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | ⑩ | ||||||
| 2 | ⑥ | ⑦ | ||||||
| 3 | ② | ③ | ④ | ⑧ | ||||
| 4 | ⑤ | ⑨ |
(1)在②、③、④三种元素的最高价氧化物的水化物中,碱性最强 的是NaOH(填化学式 ).
(2)元素①、②、⑤按原子半径由大到小的顺序依次为K>Na>H填元素符号 ),原因处于同一主族,自上而下原子半径增大
(3)元素⑥的氢化物的化学式是NH3,该氢化物溶于水,所得溶液的pH>7(填“<”、“>”或“=”).该氢化物与水发生反应的化学方程式为NH3+H2O?NH3.H2O.
(4)元素②与元素⑧形成的化合物的电子式是
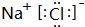 ,高温下灼烧该化合物火焰呈黄色.
,高温下灼烧该化合物火焰呈黄色.(5)Al(填化学式)的单质既可以和盐酸又可以和氢氧化钠溶液反应,它位于元素周期表中第三周期、第ⅢA族.其单质与氢氧化钠溶液反应的化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
分析 由元素在周期表中位置,可知①为H、②为Na、③为Mg、④为Al、⑤为K、⑥为N、⑦为F、⑧为Cl、⑨为Br、⑩为He.
(1)同周期自左而右金属性减弱,金属性越强,最高价氧化物的水化物的碱性越强;
(2)同主族自上而下原子半径增大;
(3)元素⑥的氢化物是NH3,该氢化物溶于水得到一水合氨,一水合氨电离得到铵根离子与氢氧根离子,溶液呈碱性;
(4)元素②与元素⑧形成的化合物为NaCl,由钠离子与氯离子构成,含有Na元素,高温下灼烧该化合物火焰呈黄色;.
(5)Al的单质既可以和盐酸又可以和氢氧化钠溶液反应,与氢氧化钠反应生成偏铝酸钠与氢气.
解答 解:由元素在周期表中位置,可知①为H、②为Na、③为Mg、④为Al、⑤为K、⑥为N、⑦为F、⑧为Cl、⑨为Br、⑩为He.
(1)同周期自左而右金属性减弱,故金属性Na>Mg>Al,金属性越强,最高价氧化物的水化物的碱性越强,故NaOH的碱性最强,故答案为:NaOH;
(2)同一主族自上而下,电子层增多,原子半径增大,故原子半径K>Na>H,
故答案为:K>Na>H;处于同一主族,自上而下原子半径增大;
(3)元素⑥的氢化物是NH3,该氢化物溶于水得到一水合氨,一水合氨电离得到铵根离子与氢氧根离子,溶液呈碱性,溶液pH>7,氨气与是反应方程式为:NH3+H2O?NH3.H2O,
故答案为:NH3;>;NH3+H2O?NH3.H2O;
(4)元素②与元素⑧形成的化合物为NaCl,由钠离子与氯离子构成,电子式为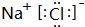 含有Na元素,高温下灼烧该化合物火焰呈黄色,
含有Na元素,高温下灼烧该化合物火焰呈黄色,
故答案为: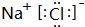 ;黄;
;黄;
(5)Al的单质既可以和盐酸又可以和氢氧化钠溶液反应,Al元素出第三周期ⅢA族,与氢氧化钠反应生成偏铝酸钠与氢气,反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:Al;三、ⅢA;2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
点评 本题考查元素周期表与元素周期律综合应用,难度不大,注意对元素周期律的理解掌握,有利于基础知识的巩固.

| A. | H2O (l)+CaO(s)═Ca(OH)2(s) | |
| B. | Ba(OH)2•8H2O+2NH4Cl═BaCl2+2NH3•H2O+8H2O | |
| C. | 2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑ | |
| D. | CH4(g)+2O2(g)$\frac{\underline{\;点燃\;}}{\;}$CO2(g)+2H2O(l) |
| A. | CS2 | B. | CH4 | C. | CH3CH2Cl | D. | CH≡CH |
| A. | NO与O2反应生成NO2 | B. | NH3经催化氧化生成NO | ||
| C. | 由NH3制碳铵和硫铵 | D. | N2与H2在一定条件下合成氨 |
| A. | 苯、溴水、铁粉混合制成溴苯 | |
| B. | 加浓溴水,然后过滤可除去苯中少量苯酚 | |
| C. | 用溴水可鉴别苯、CCl4、苯乙烯 | |
| D. | 用硝酸银溶液直接检验溴乙烷中的溴元素 |

 ;
; .
.