题目内容
4.(1)如图甲所示为二维平面晶体示意图,所表示的化学式为AX3的是②.
(2)如图乙为一个金属铜的晶胞,请完成以下各题.
①该晶胞“实际”拥有的铜原子数是4个.
②该晶胞称为C(填序号).
A.六方晶胞 B.体心立方晶胞 C.面心立方晶胞 D.简单立方晶胞
③此晶胞立方体的边长为a cm,Cu的相对原子质量为64g•mol-1,金属铜的密度为ρ g•cm-3,则阿伏加德罗常数为$\frac{256}{ρ{a}^{3}}$/mol(用a、ρ表示).
分析 (1)①每个白色小球被3个黑色小球共用,每个黑色小球被6个白色小球共用,则黑色小球和白色小球个数之比为$\frac{1}{3}:$$\frac{1}{6}$=2:1;
②每个白色小球被2个黑色小球共用,每个黑色小球被6个白色小球共用,则黑色小球和白色小球个数之比=$\frac{1}{2}$:$\frac{1}{6}$=3:1;
(2)①根据图片知,该晶胞中含有6个半个球、8个$\frac{1}{8}$球,据此计算铜原子个数;
②该晶胞属于面心立方晶胞;
③晶胞体积为a3cm3,晶胞体积=$\frac{\frac{M}{{N}_{A}}×4}{ρ}$,据此计算阿伏伽德罗常数.
解答 解:(1)①每个白色小球被3个黑色小球共用,每个黑色小球被6个白色小球共用,则黑色小球和白色小球个数之比为$\frac{1}{3}:$$\frac{1}{6}$=2:1;
②每个白色小球被2个黑色小球共用,每个黑色小球被6个白色小球共用,则黑色小球和白色小球个数之比=$\frac{1}{2}$:$\frac{1}{6}$=3:1;
所以所表示的化学式为AX3的是②,故答案为:②;
(2)①根据图片知,该晶胞中含有6个半个球、8个$\frac{1}{8}$球,则该晶胞中Cu原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故答案为:4;
②该晶胞属于面心立方晶胞,故选C;
③晶胞体积为a3cm3,晶胞体积=$\frac{\frac{M}{{N}_{A}}×4}{ρ}$,则阿伏伽德罗常数=$\frac{4M}{ρV}$=$\frac{64×4}{ρ{a}^{3}}$/mol=$\frac{256}{ρ{a}^{3}}$/mol,故答案为:$\frac{256}{ρ{a}^{3}}$/mol.
点评 本题考查晶胞计算及金属堆积模型,侧重考查学生空间想象能力及计算能力,为学习难点,明确密度公式中各个字母含义是解本题关键,易错点是(1)题.


| A. | 图1所示反应:X(g)+2Y(g)?3Z(g),b曲线表示的一定是增大压强 | |
| B. | 图2表示催化剂能改变化学反应的焓变 | |
| C. | 图3表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)═N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 | |
| D. | 图3表示向稀CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b |
 :则A的同分异构体中带苯环的化合物共有( )
:则A的同分异构体中带苯环的化合物共有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
| A. | KCl和K2O都属于盐 | B. | H2SO4和HNO3都属于酸 | ||
| C. | KOH和Na2CO3都属于碱 | D. | Na2O和Na2SiO3都属于氧化物 |
| A. | 原子间通过共用电子对所形成的化学键叫共价键 | |
| B. | 成键原子间原子轨道重叠越多,共价键越牢固 | |
| C. | 对双原子分子来讲,键能越大,含有该键的分子越稳定 | |
| D. | 键长越长,化学键越牢固 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | ⑩ | ||||||
| 2 | ⑥ | ⑦ | ||||||
| 3 | ② | ③ | ④ | ⑧ | ||||
| 4 | ⑤ | ⑨ |
(1)在②、③、④三种元素的最高价氧化物的水化物中,碱性最强 的是NaOH(填化学式 ).
(2)元素①、②、⑤按原子半径由大到小的顺序依次为K>Na>H填元素符号 ),原因处于同一主族,自上而下原子半径增大
(3)元素⑥的氢化物的化学式是NH3,该氢化物溶于水,所得溶液的pH>7(填“<”、“>”或“=”).该氢化物与水发生反应的化学方程式为NH3+H2O?NH3.H2O.
(4)元素②与元素⑧形成的化合物的电子式是
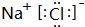 ,高温下灼烧该化合物火焰呈黄色.
,高温下灼烧该化合物火焰呈黄色.(5)Al(填化学式)的单质既可以和盐酸又可以和氢氧化钠溶液反应,它位于元素周期表中第三周期、第ⅢA族.其单质与氢氧化钠溶液反应的化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑.

| A. | 该药物可以用有机溶剂萃取 | |
| B. | 该有机物可与NaOH和NaHCO3发生反应 | |
| C. | 1mol该有机物可以与5mol Br2发生反应 | |
| D. | 该有机物分子中,可能有16个碳原子共平面 |
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 酒精(水) | 生石灰 | 蒸馏 |
| C | 苯(甲苯) | 酸性KMnO4溶液 | 分液 |
| D | 乙烷(乙烯) | Br2的CCl4溶液 | 洗气 |
| A. | A | B. | B | C. | C D.D |
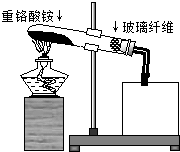 氮及其化合物在化学实验中有广泛应用:
氮及其化合物在化学实验中有广泛应用: