题目内容
19.中华人民共和国国家标准(GB27602011)规定葡萄酒中SO2最大使用量为0.25g•L-1.某兴趣小组测定某葡萄酒中SO2含量.步骤如下:(1)取300.00mL葡萄酒,加入适量盐酸,加热使SO2全部逸出
(2)逸出的SO2被稍过量的H2O2完全吸收氧化
(3)加热(2)中溶液,除尽过量的H2O2,然后用0.090 0mol•L-1NaOH标准溶液进行滴定,以酚酞为指示剂,滴定到终点,记录消耗NaOH溶液的体积
(4)重复上述操作2~3次
试回答:
(1)步骤2中H2O2 氧化SO2的化学方程式为SO2+H2O2═H2SO4.
(2)NaOH标准溶液用碱式滴定管(填“碱式或酸式”)盛装
(3)到达滴定终点时,溶液由无色变为浅红色,且30S内不再变化;
(4)若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)④(①=10mL,②=40mL,③<10mL,④>40mL).
(5)滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为0.24g•L-1.
(6)以下操作使所测得的SO2含量偏高的是A
A.滴定前,未用NaOH标准溶液润洗滴定管
B.滴定前滴定管内无气泡,终点读数时有气泡
C.滴定前仰视读数,滴定终点时读数正确.
分析 (1)二氧化硫具有还原性,能够与实验室反应生成硫酸,据此写出反应的方程式;
(2)碱性溶液用碱式滴定管盛放;
(3)用NaOH标准溶液滴定硫酸,则溶液由酸性变碱性;
(4)若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,滴定管的0刻度在上方,10mL刻度线下方还有40mL有刻度的溶液,另外滴定管50mL刻度线下有液体,据此计算;
(5)根据关系式2NaOH~H2SO4~SO2及氢氧化钠的物质的量计算出二氧化硫的质量,再计算出该葡萄酒中的二氧化硫含量;
(6)根据n(H2SO4)=2n(NaOH)=2V(碱)×c(碱),分析不当操作对n(酸)的影响,以此判断SO2含量的变化.
解答 解:(1)双氧水具有氧化性,能够将二氧化硫氧化成硫酸,反应的化学方程式为:SO2+H2O2=H2SO4,故答案为:SO2+H2O2=H2SO4;
(2)碱性溶液用碱式滴定管盛放,则NaOH标准溶液用碱式滴定管盛放,故答案为:碱式;
(3)用NaOH标准溶液滴定硫酸,则溶液由酸性变碱性,以酚酞为指示剂,所以滴定到终点溶液由无色变为浅红色,故答案为:无;浅红;
(4)若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,滴定管的0刻度在上方,10mL刻度线下方还有40mL有刻度的溶液,另外滴定管50mL刻度线下有液体,因此管内的液体体积>(50.00mL-10.00mL)=40.00mL,所以④正确,
故答案为:④;
(5)根据2NaOH~H2SO4~SO2可知SO2的质量为:$\frac{1}{2}$×0.0900mol/L×0.025L×64g/mol=0.072g,该葡萄酒中的二氧化硫含量为:$\frac{0.072g}{0.3L}$=0.24g/L,
故答案为:0.24;
(6)A.滴定前,未用NaOH标准溶液润洗滴定管,则氢氧化钠的浓度减小,滴定时消耗的氢氧化钠偏多,则n(H2SO4)=2n(NaOH)=2V(碱)×c(碱)可知计算得到的硫酸的物质的量偏大,则二氧化硫的物质的量偏大,即所测得的SO2含量偏高,故A正确;
B.滴定前滴定管内无气泡,终点读数时有气泡,则滴定时消耗的氢氧化钠偏少,则n(H2SO4)=2n(NaOH)=2V(碱)×c(碱)可知计算得到的硫酸的物质的量偏小,则二氧化硫的物质的量偏小,即所测得的SO2含量偏低,故B错误;
C.滴定前仰视读数,滴定终点时读数正确,则滴定时消耗的氢氧化钠偏少,则n(H2SO4)=2n(NaOH)=2V(碱)×c(碱)可知计算得到的硫酸的物质的量偏小,则二氧化硫的物质的量偏小,即所测得的SO2含量偏低,故C错误;
故答案为:A.
点评 本题为考查了探究物质的组成、测量物质的含量的方法,题目难度中等,试题涉及了二氧化硫性质、中和滴定的计算,要求学生掌握探究物质组成、测量物质含量的方法,明确二氧化硫的化学性质及中和滴定的操作方法及计算方法,试题培养了学生灵活应用所学知识的能力.

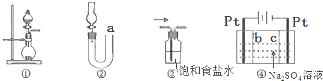
| A. | 图①可用于实验室制取少量NH3或O2 | |
| B. | 可用从a处加水的方法检验图②装置的气密性 | |
| C. | 实验室可用图③的方法除去Cl2中混有的HCl | |
| D. | 利用图④装置制硫酸和氢氧化钠,其中b为阳离子交换膜 |
| A. | 单位时间里生成 n mol A2,同时消耗 2n mol AB | |
| B. | 容器中的总压强不随时间而变化 | |
| C. | A2、B2、AB的物质的量之比满足1:1:2 | |
| D. | 单位时间里生成2n mol AB的同时生成n mol B2 |
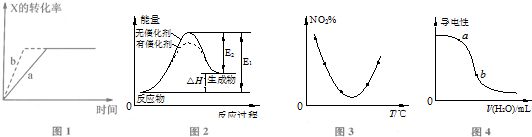
| A. | 图1所示反应:X(g)+2Y(g)?3Z(g),b曲线表示的一定是增大压强 | |
| B. | 图2表示催化剂能改变化学反应的焓变 | |
| C. | 图3表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)═N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 | |
| D. | 图3表示向稀CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b |
①增加X ②降低温度 ③增大压强 ④降低压强 ⑤加入正催化剂 ⑥分离出Z.
| A. | ①③⑤ | B. | ②③⑥ | C. | ②③⑤ | D. | ②④⑥ |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | ⑩ | ||||||
| 2 | ⑥ | ⑦ | ||||||
| 3 | ② | ③ | ④ | ⑧ | ||||
| 4 | ⑤ | ⑨ |
(1)在②、③、④三种元素的最高价氧化物的水化物中,碱性最强 的是NaOH(填化学式 ).
(2)元素①、②、⑤按原子半径由大到小的顺序依次为K>Na>H填元素符号 ),原因处于同一主族,自上而下原子半径增大
(3)元素⑥的氢化物的化学式是NH3,该氢化物溶于水,所得溶液的pH>7(填“<”、“>”或“=”).该氢化物与水发生反应的化学方程式为NH3+H2O?NH3.H2O.
(4)元素②与元素⑧形成的化合物的电子式是
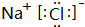 ,高温下灼烧该化合物火焰呈黄色.
,高温下灼烧该化合物火焰呈黄色.(5)Al(填化学式)的单质既可以和盐酸又可以和氢氧化钠溶液反应,它位于元素周期表中第三周期、第ⅢA族.其单质与氢氧化钠溶液反应的化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
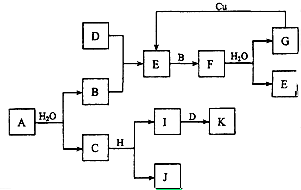 A~K为中学化学的常见物质,它们之间有如下图所示的转化关系(反应条件已略去).已知:通常状况下,A是淡黄色固体,B、D和I都是无色气体单质,F是红棕色气体,H是金属单质.回答下列问题:
A~K为中学化学的常见物质,它们之间有如下图所示的转化关系(反应条件已略去).已知:通常状况下,A是淡黄色固体,B、D和I都是无色气体单质,F是红棕色气体,H是金属单质.回答下列问题: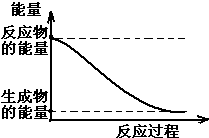 (1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是放热.(填“吸热”或“放热”)反应,NO2和CO的总能量大于(填
(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是放热.(填“吸热”或“放热”)反应,NO2和CO的总能量大于(填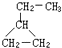 可表示为
可表示为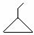 ,则金刚乙烷、金刚乙胺的结构简式可用如图
,则金刚乙烷、金刚乙胺的结构简式可用如图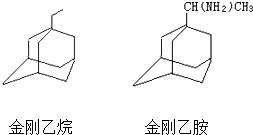 表示.
表示.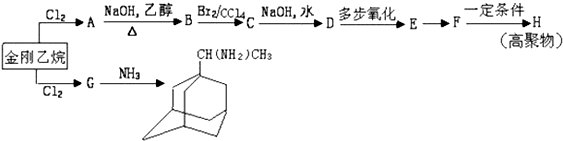
 +2NH3→
+2NH3→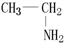 +NH4Cl
+NH4Cl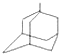 ,如金刚乙烷表示为R-CH2CH3)
,如金刚乙烷表示为R-CH2CH3)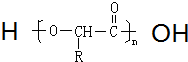 .
.