题目内容
20.下列可设计成原电池的化学反应是( )| A. | H2O (l)+CaO(s)═Ca(OH)2(s) | |
| B. | Ba(OH)2•8H2O+2NH4Cl═BaCl2+2NH3•H2O+8H2O | |
| C. | 2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑ | |
| D. | CH4(g)+2O2(g)$\frac{\underline{\;点燃\;}}{\;}$CO2(g)+2H2O(l) |
分析 常温下能自动发生的氧化还原反应可设计成原电池,且为放热反应,以此来解答.
解答 解:A.反应中没有元素的化合价变化,不属于氧化还原反应,不能设计成原电池,故A错误;
B.为吸热反应,且不是氧化还原反应,不能设计成原电池,故B错误;
C.为吸热反应,不能设计成原电池,故C错误;
D.C、O元素的化合价变化,为氧化还原反应,反应放热,可设计成原电池,故D正确.
故选D.
点评 本题考查原电池的设计,为高频考点,把握原电池反应与氧化还原反应的关系为解答的关键,注意常温下发生的氧化还原反应理论上可设计成原电池,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.在一定温度下,反应A2(g)+B2(g)$\stackrel{.}{?}$2AB(g)达到平衡状态的标志是( )
| A. | 单位时间里生成 n mol A2,同时消耗 2n mol AB | |
| B. | 容器中的总压强不随时间而变化 | |
| C. | A2、B2、AB的物质的量之比满足1:1:2 | |
| D. | 单位时间里生成2n mol AB的同时生成n mol B2 |
11.有一处于平衡状态的反应:X(s)+3Y(g)═2Z(g)(正反应是放热反应).为了使平衡向生成Z的方向移动,应选择的条件是( )
①增加X ②降低温度 ③增大压强 ④降低压强 ⑤加入正催化剂 ⑥分离出Z.
①增加X ②降低温度 ③增大压强 ④降低压强 ⑤加入正催化剂 ⑥分离出Z.
| A. | ①③⑤ | B. | ②③⑥ | C. | ②③⑤ | D. | ②④⑥ |
15.有机物A的结构简式为 :则A的同分异构体中带苯环的化合物共有( )
:则A的同分异构体中带苯环的化合物共有( )
 :则A的同分异构体中带苯环的化合物共有( )
:则A的同分异构体中带苯环的化合物共有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
12.分类是学习和研究化学的一种重要方法,下列分类合理的是( )
| A. | KCl和K2O都属于盐 | B. | H2SO4和HNO3都属于酸 | ||
| C. | KOH和Na2CO3都属于碱 | D. | Na2O和Na2SiO3都属于氧化物 |
9.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.表列出了①~⑩九种元素在周期表中的位置.
请回答:(以下用相应的元素符号 或化学式 回答问题 )
(1)在②、③、④三种元素的最高价氧化物的水化物中,碱性最强 的是NaOH(填化学式 ).
(2)元素①、②、⑤按原子半径由大到小的顺序依次为K>Na>H填元素符号 ),原因处于同一主族,自上而下原子半径增大
(3)元素⑥的氢化物的化学式是NH3,该氢化物溶于水,所得溶液的pH>7(填“<”、“>”或“=”).该氢化物与水发生反应的化学方程式为NH3+H2O?NH3.H2O.
(4)元素②与元素⑧形成的化合物的电子式是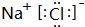 ,高温下灼烧该化合物火焰呈黄色.
,高温下灼烧该化合物火焰呈黄色.
(5)Al(填化学式)的单质既可以和盐酸又可以和氢氧化钠溶液反应,它位于元素周期表中第三周期、第ⅢA族.其单质与氢氧化钠溶液反应的化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | ⑩ | ||||||
| 2 | ⑥ | ⑦ | ||||||
| 3 | ② | ③ | ④ | ⑧ | ||||
| 4 | ⑤ | ⑨ |
(1)在②、③、④三种元素的最高价氧化物的水化物中,碱性最强 的是NaOH(填化学式 ).
(2)元素①、②、⑤按原子半径由大到小的顺序依次为K>Na>H填元素符号 ),原因处于同一主族,自上而下原子半径增大
(3)元素⑥的氢化物的化学式是NH3,该氢化物溶于水,所得溶液的pH>7(填“<”、“>”或“=”).该氢化物与水发生反应的化学方程式为NH3+H2O?NH3.H2O.
(4)元素②与元素⑧形成的化合物的电子式是
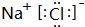 ,高温下灼烧该化合物火焰呈黄色.
,高温下灼烧该化合物火焰呈黄色.(5)Al(填化学式)的单质既可以和盐酸又可以和氢氧化钠溶液反应,它位于元素周期表中第三周期、第ⅢA族.其单质与氢氧化钠溶液反应的化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
10.下列叙述I和II均正确并有因果关系的是( )
| 选项 | 叙述I | 叙述II |
| A | 晶体硅熔点高硬度大 | 可用于制作半导体材料 |
| B | BaSO4难溶于酸 | 用硫酸和BaCl2溶液检验SO42- |
| C | NH3极易溶于水 | NH3可用于设计喷泉实验 |
| D | NaOH可以与SiO2反应 | 用NaOH溶液雕刻工艺玻璃上的纹饰 |
| A. | A | B. | B | C. | C | D. | D |
 可表示为
可表示为 ,则金刚乙烷、金刚乙胺的结构简式可用如图
,则金刚乙烷、金刚乙胺的结构简式可用如图 表示.
表示.
 +2NH3→
+2NH3→ +NH4Cl
+NH4Cl ,如金刚乙烷表示为R-CH2CH3)
,如金刚乙烷表示为R-CH2CH3) .
.