题目内容
1.下列反应中能起到固氮作用的是( )| A. | NO与O2反应生成NO2 | B. | NH3经催化氧化生成NO | ||
| C. | 由NH3制碳铵和硫铵 | D. | N2与H2在一定条件下合成氨 |
分析 氮的固定是游离态的氮转化为化合态的过程,由单质转化为化合物都叫固氮,包括自然固氮和人工固氮.
解答 解:A.一氧化氮和二氧化氮之间的转化,是氮元素不同化合物之间的转化,不是固氮,故A错误;
B.由NH3氧化制NO是氮元素化合态之间的相互转化,不是固氮,故B错误;
C.NH3制碳酸氢铵和硫酸铵是氮的化合物之间的转化,不是固氮作用的反应,故B错误;
D.N2与H2在一定条件下反应生成NH3,氮由单质转化为化合物,符合氮的固定的定义,故D正确;
故选D.
点评 判断氮的固定的关键是抓住氮元素的化合价是否从0价变为其他化合价,即从单质转化为化合物,题目简单.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
11.有一处于平衡状态的反应:X(s)+3Y(g)═2Z(g)(正反应是放热反应).为了使平衡向生成Z的方向移动,应选择的条件是( )
①增加X ②降低温度 ③增大压强 ④降低压强 ⑤加入正催化剂 ⑥分离出Z.
①增加X ②降低温度 ③增大压强 ④降低压强 ⑤加入正催化剂 ⑥分离出Z.
| A. | ①③⑤ | B. | ②③⑥ | C. | ②③⑤ | D. | ②④⑥ |
12.分类是学习和研究化学的一种重要方法,下列分类合理的是( )
| A. | KCl和K2O都属于盐 | B. | H2SO4和HNO3都属于酸 | ||
| C. | KOH和Na2CO3都属于碱 | D. | Na2O和Na2SiO3都属于氧化物 |
9.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.表列出了①~⑩九种元素在周期表中的位置.
请回答:(以下用相应的元素符号 或化学式 回答问题 )
(1)在②、③、④三种元素的最高价氧化物的水化物中,碱性最强 的是NaOH(填化学式 ).
(2)元素①、②、⑤按原子半径由大到小的顺序依次为K>Na>H填元素符号 ),原因处于同一主族,自上而下原子半径增大
(3)元素⑥的氢化物的化学式是NH3,该氢化物溶于水,所得溶液的pH>7(填“<”、“>”或“=”).该氢化物与水发生反应的化学方程式为NH3+H2O?NH3.H2O.
(4)元素②与元素⑧形成的化合物的电子式是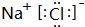 ,高温下灼烧该化合物火焰呈黄色.
,高温下灼烧该化合物火焰呈黄色.
(5)Al(填化学式)的单质既可以和盐酸又可以和氢氧化钠溶液反应,它位于元素周期表中第三周期、第ⅢA族.其单质与氢氧化钠溶液反应的化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | ⑩ | ||||||
| 2 | ⑥ | ⑦ | ||||||
| 3 | ② | ③ | ④ | ⑧ | ||||
| 4 | ⑤ | ⑨ |
(1)在②、③、④三种元素的最高价氧化物的水化物中,碱性最强 的是NaOH(填化学式 ).
(2)元素①、②、⑤按原子半径由大到小的顺序依次为K>Na>H填元素符号 ),原因处于同一主族,自上而下原子半径增大
(3)元素⑥的氢化物的化学式是NH3,该氢化物溶于水,所得溶液的pH>7(填“<”、“>”或“=”).该氢化物与水发生反应的化学方程式为NH3+H2O?NH3.H2O.
(4)元素②与元素⑧形成的化合物的电子式是
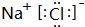 ,高温下灼烧该化合物火焰呈黄色.
,高温下灼烧该化合物火焰呈黄色.(5)Al(填化学式)的单质既可以和盐酸又可以和氢氧化钠溶液反应,它位于元素周期表中第三周期、第ⅢA族.其单质与氢氧化钠溶液反应的化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
16.己烯雌酚是一种激素类药物,结构如图所示,下列有关叙述中不正确的是( )

| A. | 该药物可以用有机溶剂萃取 | |
| B. | 该有机物可与NaOH和NaHCO3发生反应 | |
| C. | 1mol该有机物可以与5mol Br2发生反应 | |
| D. | 该有机物分子中,可能有16个碳原子共平面 |
13.除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法不能达到实验目的是( )
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 酒精(水) | 生石灰 | 蒸馏 |
| C | 苯(甲苯) | 酸性KMnO4溶液 | 分液 |
| D | 乙烷(乙烯) | Br2的CCl4溶液 | 洗气 |
| A. | A | B. | B | C. | C D.D |
10.下列叙述I和II均正确并有因果关系的是( )
| 选项 | 叙述I | 叙述II |
| A | 晶体硅熔点高硬度大 | 可用于制作半导体材料 |
| B | BaSO4难溶于酸 | 用硫酸和BaCl2溶液检验SO42- |
| C | NH3极易溶于水 | NH3可用于设计喷泉实验 |
| D | NaOH可以与SiO2反应 | 用NaOH溶液雕刻工艺玻璃上的纹饰 |
| A. | A | B. | B | C. | C | D. | D |