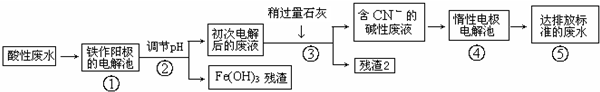
题目内容
13.NH4Cl晶体中含有多种化学键,其中一定不含有的化学键是( )| A. | 离子键 | B. | π键 | C. | 配位键 | D. | 氢键 |
分析 因NH4Cl的电子式为: ,铵根离子和氯离子之间存在离子键,氮原子和氢原子之间存在极性共价键和配位键,无双键,由此分析.
,铵根离子和氯离子之间存在离子键,氮原子和氢原子之间存在极性共价键和配位键,无双键,由此分析.
解答 解:A、铵根离子与氯离子之间存在离子键,故A不选;
B、无不饱和键,所以无π键,故选B;
C、氮与氢原子之间存在配位键,故C不选;
D、氢键不是化学键,故D不选;
故选B.
点评 本题考查离子化合物、共价化合物与化学键的关系,明确物质中存在的微粒及微粒之间作用力即可解答,注意不能根据是否含有金属元素判断化学键,为易错点.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
8.用分液漏斗可以分离的一组混合物是( )
| A. | 溴苯和水 | B. | 丙醇和乙二醇 | C. | 碘和乙醇 | D. | 甘油和水 |
18.下列表示式错误的是( )
| A. | Na+的轨道表示式: | B. | Na+的结构示意图: | ||
| C. | Na的电子排布式:1s22s22p63s1 | D. | Na的简化电子排布式:[Ne]3s1 |
2.下列物质中,既能使溴水褪色,又能产生沉淀的是( )
| A. | 丁烯 | B. | 乙醇 | C. | 苯酚 | D. | 乙酸 |
3. 与等物质的量的Br2发生加成反应,生成的产物是( )
与等物质的量的Br2发生加成反应,生成的产物是( )
 与等物质的量的Br2发生加成反应,生成的产物是( )
与等物质的量的Br2发生加成反应,生成的产物是( )| A. | 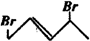 | B. | 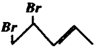 | C. |  | D. |  |
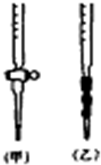 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.