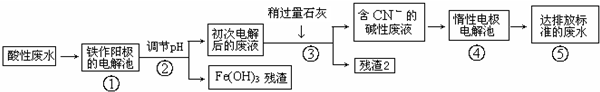
题目内容
17.向下例配合物的水溶液中加入AgNO3溶液,不能生成AgCl沉淀的是( )| A. | [Co(NH3)3Cl3] | B. | [Co(NH3)6]Cl3 | C. | [Co(NH3)4Cl2]Cl | D. | [Co(NH3)5Cl]Cl2 |
分析 配合物中阴离子能和银离子反应生成氯化银沉淀,配原子不和银离子反应,据此分析解答.
解答 解:A、[Co(NH3)3Cl3]中没有阴离子氯离子,所以不能和硝酸银反应生成氯化银沉淀,故A正确;
B、[Co(NH3)6]Cl3中有阴离子氯离子,所以能和硝酸银反应生成氯化银沉淀,故B错误;
C、[Co(NH3)4Cl2]Cl中有阴离子氯离子,所以能和硝酸银反应生成氯化银沉淀,故C错误;
D、[Co(NH3)5Cl]Cl2中有阴离子氯离子,所以能和硝酸银反应生成氯化银沉淀,故D错误.
故选A.
点评 本题考查了配合物中的成键情况,根据“配合物中阴离子能和银离子反应生成氯化银沉淀,配原子不和银离子反应”来分析解答即可,难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
2.下列物质中,既能使溴水褪色,又能产生沉淀的是( )
| A. | 丁烯 | B. | 乙醇 | C. | 苯酚 | D. | 乙酸 |
 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.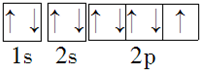 .
.