题目内容
14.下列物质是共价化合物的是( )| A. | H2SO4 | B. | MgCl2 | C. | N2 | D. | NH4Cl |
分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,只含共价键的化合物是共价化合物,共价化合物中一定不含离子键,据此分析解答.
解答 解:A.硫酸分子中S-O、H-O原子之间只存在共价键,为共价化合物,故A正确;
B.氯化镁中镁离子和氯离子之间只存在离子键,为离子化合物,故B错误;
C.氮气分子中N-N原子之间只存在共价键,但氮气是单质,故C错误;
D.氯化铵中铵根离子和氯离子之间只存在离子键、铵根离子中N-H原子之间存在共价键,为离子化合物,故D错误;
故选A.
点评 本题考查离子化合物和共价化合物判断,为高频考点,明确离子化合物和共价化合物的区别是解本题关键,注意不能根据是否含有金属元素判断离子键,为易错点.

练习册系列答案
相关题目
2.下列物质中,既能使溴水褪色,又能产生沉淀的是( )
| A. | 丁烯 | B. | 乙醇 | C. | 苯酚 | D. | 乙酸 |
9.元素性质呈周期性变化的决定因素是( )
| A. | 元素原子半径大小呈周期性变化 | |
| B. | 元素原子量依次递增 | |
| C. | 元素的最高正化合价呈周期性变化 | |
| D. | 元素原子最外层电子排布呈周期性变化 |
19. 高温下超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价.如图所示为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是( )
高温下超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价.如图所示为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是( )
 高温下超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价.如图所示为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是( )
高温下超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价.如图所示为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是( )| A. | 超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2- | |
| B. | 晶体中每个K+周围有8个O2-,每个O2-周围有8个K+ | |
| C. | 晶体中与每个K+距离最近的K+有8个 | |
| D. | 晶体中,0价氧与-2价氧的数目比为2:1 |
6.下列反应中,不属于氧化还原反应的是( )
| A. | 2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$ 2H2O+O2↑ | |
| B. | NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HCl↑ | |
| C. | 2Al+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$ 2Fe+Al2O3 | |
| D. | Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O |
3. 与等物质的量的Br2发生加成反应,生成的产物是( )
与等物质的量的Br2发生加成反应,生成的产物是( )
 与等物质的量的Br2发生加成反应,生成的产物是( )
与等物质的量的Br2发生加成反应,生成的产物是( )| A. | 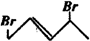 | B. | 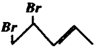 | C. |  | D. |  |
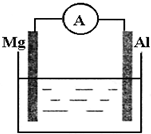 如图所示装置
如图所示装置