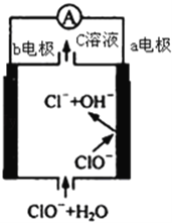
题目内容
【题目】为测定Na2CO3和NaHCO3固体混合物样品的组成,称取四份质量均为2.96g的固体溶于水,分别往四份溶液中逐滴加入不同体积1.00mol·L-1的盐酸,加入盐酸溶液的体积和收集到CO2气体的体积(忽略气体在水中的溶解,气体体积均已折算成标准状况下的体积)如表所示:
实验序号 | 1 | 2 | 3 | 4 |
盐酸体积/mL | 20 | 40 | 60 | 80 |
CO2体积/mL | 0 | 448 | 672 | 672 |
下列说法不正确的是
A.实验1中发生反应的离子方程式为:CO![]() +H+=HCO
+H+=HCO![]()
B.实验2溶液中,含有NaCl、Na2CO3和NaHCO3三种溶质
C.实验3和实验4蒸干溶液所得固体一定是NaCl
D.原固体混合物中Na2CO3和NaHCO3的物质的量之比为2:1
【答案】B
【解析】
Na2CO3和NaHCO3固体混合物中滴加盐酸,开始没有气体生成,发生的反应为CO![]() +H+=HCO
+H+=HCO![]() ,再加盐酸,开始有气体生成,发生的反应为HCO
,再加盐酸,开始有气体生成,发生的反应为HCO![]() + H+=CO2
+ H+=CO2![]() +H2O,由表格可知,气体体积为672mL时反应结束。
+H2O,由表格可知,气体体积为672mL时反应结束。
A.根据分析,实验1中尚未出现气体,故发生的反应为CO![]() +H+=HCO
+H+=HCO![]() ,A正确,不选;
,A正确,不选;
B.实验2已经开始生成气体,溶液中没有Na2CO3,B错误,符合题意;
C.通过表格中生成的气体量,可以推断实验3和实验4已经反应完,溶液中有NaCl和HCl,蒸干后只剩NaCl,C正确,不选;
D.设Na2CO3的物质的量为x,NaHCO3的物质的量为y,672mlCO2的物质的量为![]() ,根据题意可得
,根据题意可得
![]() ,解得
,解得![]() ,故Na2CO3和NaHCO3的物质的量之比为2:1,D正确,不选;
,故Na2CO3和NaHCO3的物质的量之比为2:1,D正确,不选;
故选B。

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目