题目内容
【题目】镁﹣次氯酸盐燃料电池的工作原理如图,该电池反应为:Mg+ClO﹣+H2O═Mg(OH)2+Cl﹣下列有关说法正确的是( )
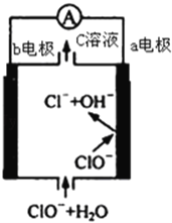
A. 电池工作时,C溶液中的溶质是MgCl2
B. 电池工作时,正极a附近的pH将不断增大
C. 负极反应式:ClO﹣﹣2e﹣+H2O═Cl﹣+2 OH﹣
D. b电极发生还原反应,每转移0.1mol电子,理论上生成0.1mol Cl﹣
【答案】B
【解析】
试题A.根据电池反应式为Mg+ClO-+H2O=Mg(OH)2+Cl-,所以C溶液中的溶质不含镁离子,A错误;B.放电时正极电极反应式为:ClO-+H2O+2e-=Cl-+2OH-,所以a附近的pH将不断增大,B正确;C.根据电池反应式为Mg+ClO-+H2O=Mg(OH)2+Cl-可知负极电极反应式为Mg-2e-+2OH-=Mg(OH)2,C错误;D.由可知b电极为正极发生还原反应,反应式为:ClO-+H2O+2e-=Cl-+2OH-,所以每转移0.1mol电子,理论上生成0.05mol Cl,D错误;答案选B。

 阅读快车系列答案
阅读快车系列答案【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)表中元素原子半径最大的是(写元素符号)___,Y原子的电子排布式是__,Z原子核外电子能量最高的电子亚层是___。
(2)下列事实能说明Y元素的非金属性比S元素强的是___;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1mol Y单质比1mol S得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(3)CCl4是一种常见的有机溶剂,写出其电子式___,判断其属于含有___(填“极性”、“非极性”)共价键的____分子(填“极性”或“非极性”)。SiH4的沸点比CH4高,原因是___。
(4)碳酸钠溶液中滴入酚酞,溶液显红色,请用离子方程式说明产生该现象的原因:___,在上述红色的溶液中加入少许氯化钙固体,溶液颜色变浅,请用平衡理论解释产生该现象的原因____。