题目内容
【题目】气体A、B分别为0.6 mol和0.5 mol,在0.4 L密闭容器中发生反应:3A+BaC+2D,经5 min后,此时C为0.2mol,又知在此反应时间内,D的平均反应速率为0.1 mol·(L·min)-1,下列结论正确的是( )
A.A的平均反应速率为0.1 mol·(L·min)-1B.a值为2
C.B的转化率为50%D.此时,反应混合物总的物质的量为1 mol
【答案】B
【解析】
根据题意可知,在此反应时间D的平均反应速率为0.1mol·L-1·min-1,则D的物质的量变化为0.2mol,利用三段式

A. 在此反应时间,D的平均反应速率 为0.1mol·L-1·min-1,根据化学计量数关系可知,A的平均反应速率为0.15mol·L-1·min-1,A错误;
B. C和D两种物质的变化量相等,说明C和D的化学计量数相等,a值为2,B正确;
C. B的转化率为: ,C错误;
,C错误;
D. 结合以上分析,平衡时,反应混合物总物质的量为1.1mol,D错误;
故答案为:B。

【题目】实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH![]() +6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,1 mol (CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
+6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,1 mol (CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ 称取样品1.5 g;
步骤Ⅱ 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀;
步骤Ⅲ 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞溶液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①NaOH标准溶液盛放在____滴定管中,若滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮元素的质量分数________(填“偏大”“偏小”或“无影响”)。
②滴定达到终点时,酚酞指示剂由________色变成________色。
③下列有关实验操作的说法正确的是__________(双选)。
A.锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积不变
B.滴定终点时,俯视读数,使测定结果偏小
C.只能选用酚酞作指示剂
D.滴入最后一滴NaOH溶液,溶液突然变色,即为滴定终点
E.滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面
(2)滴定结果如下表所示:
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.20 | 20.20 |
则所用去的NaOH标准溶液的平均体积为_______ mL,若NaOH标准溶液的浓度为0.100 0 mol·L-1,则该样品中氮元素的质量分数为___________。(列出计算式并计算结果)
【题目】实验能力和创新意识是化学学科核心素养的重要内容之一。某研究性学习小组在验证反应“ Fe![]() ”的实验中检测到
”的实验中检测到![]() 发现和探究过程如下:向硝酸酸化的
发现和探究过程如下:向硝酸酸化的![]() 硝酸银溶液(
硝酸银溶液(![]() )中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物:
①检验上层清液中所含离子的方法:取上层清液,滴加_________,产生蓝色沉淀,说明溶液中含有Fe2+。
②经检验黑色固体为Ag,检验方法:取出少量黑色固体,洗涤后,加入适量稀硝酸使固体溶解,再滴加__________(填试剂),产生_________(填现象)。
(2)针对“溶液呈黄色”,甲认为溶液中有![]() 乙认为铁粉过量时不可能有
乙认为铁粉过量时不可能有![]() ,乙依据的原理是______。(用离子方程式表示)o
,乙依据的原理是______。(用离子方程式表示)o
针对这两种观点继续实验:取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号 | 取样时间/min | 现象 |
I | 3 | 产生大量白色沉淀;溶液呈红色 |
II | 30 | 产生白色沉淀,较3 min时量少;溶液红色较3 min时加深 |
III | 120 | 产生白色沉淀,较30min时量少;溶液红色较30min时变浅 |
(资料: ![]() -生成白色沉淀AgSCN)
-生成白色沉淀AgSCN)
(3)实验中溶液变为红色的离子方程式为_______________,产生白色沉淀说明存在___________(填离子符号)。
(4)对![]() 产生的原因做如下假设:
产生的原因做如下假设:
假设a:可能是铁粉表面有氧化层,能产生![]()
假设b:空气中存在![]() 发生反应
发生反应![]() 产生
产生![]()
假设c:酸性溶液中的NO3-将Fe2+氧化为Fe3+
假设d:溶液存在Ag+将Fe2+氧化为Fe3+
下述实验可证实假设a、b
①实验:向硝酸酸化的__________溶液( ![]() )中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液。3min 时溶液呈浅红色,30min后溶液几乎无色。
)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液。3min 时溶液呈浅红色,30min后溶液几乎无色。
②实验II的现象说明发生了反应__________(用离子方程式表示)。
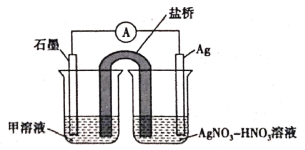
(5)实验Ⅱ中发生的反应可以用下列装置来验证。其中甲溶液是___________,分别取电池工作前与工作一段时间后左侧烧杯中溶液,同时滴加KSCN溶液,_______ (“前者”或“后者”)红色更深。
【题目】为测定Na2CO3和NaHCO3固体混合物样品的组成,称取四份质量均为2.96g的固体溶于水,分别往四份溶液中逐滴加入不同体积1.00mol·L-1的盐酸,加入盐酸溶液的体积和收集到CO2气体的体积(忽略气体在水中的溶解,气体体积均已折算成标准状况下的体积)如表所示:
实验序号 | 1 | 2 | 3 | 4 |
盐酸体积/mL | 20 | 40 | 60 | 80 |
CO2体积/mL | 0 | 448 | 672 | 672 |
下列说法不正确的是
A.实验1中发生反应的离子方程式为:CO![]() +H+=HCO
+H+=HCO![]()
B.实验2溶液中,含有NaCl、Na2CO3和NaHCO3三种溶质
C.实验3和实验4蒸干溶液所得固体一定是NaCl
D.原固体混合物中Na2CO3和NaHCO3的物质的量之比为2:1