题目内容
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是

A.AB(g)中的键能是0.5bkJ·mol-1
B.该反应是放热反应
C.该反应的热化学方程式为:A2(g)+B2(g)=2AB(g)△H=-(a-b)kJ·mol-1
D.每生成1molA2和1molB2,放出akJ热量
【答案】A
【解析】
A.由图示可知,生成2molAB(g)放出bkJ能量,故AB(g)中的键能是0.5bkJ·mol-1,A正确;
B.由图示可知,反应物的总能量小于生成物的总能量,该反应为吸热反应,B错误;
C.该反应为吸热反应,故该反应的热化学方程式为:A2(g)+B2(g)=====2AB(g)△H=+(a-b)kJ·mol-1
D.由图示分析可知,2molAB(g) 生成1molA2和1molB2,放出(a-b)kJ热量,故D错误;
答案选A。

 口算题天天练系列答案
口算题天天练系列答案【题目】为测定Na2CO3和NaHCO3固体混合物样品的组成,称取四份质量均为2.96g的固体溶于水,分别往四份溶液中逐滴加入不同体积1.00mol·L-1的盐酸,加入盐酸溶液的体积和收集到CO2气体的体积(忽略气体在水中的溶解,气体体积均已折算成标准状况下的体积)如表所示:
实验序号 | 1 | 2 | 3 | 4 |
盐酸体积/mL | 20 | 40 | 60 | 80 |
CO2体积/mL | 0 | 448 | 672 | 672 |
下列说法不正确的是
A.实验1中发生反应的离子方程式为:CO![]() +H+=HCO
+H+=HCO![]()
B.实验2溶液中,含有NaCl、Na2CO3和NaHCO3三种溶质
C.实验3和实验4蒸干溶液所得固体一定是NaCl
D.原固体混合物中Na2CO3和NaHCO3的物质的量之比为2:1
【题目】今有室温下四种溶液,有关叙述不正确的是
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH①>②>④>③
D. V1L④与V2L①溶液混合后,若混合后溶液pH=7,则V1<V2
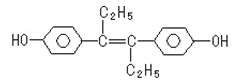
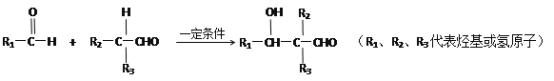
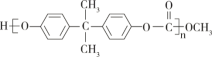
【题目】苯甲酸甲酯是一种重要的工业原料,有机化学中通过酯化反应原理,可以进行苯甲酸甲酯的合成。有关物质的物理性质、实验装置如下所示:
苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
熔点/℃ | 122.4 | ﹣97 | ﹣12.3 |
沸点/℃ | 249 | 64.3 | 199.6 |
密度/g.cm﹣3 | 1.2659 | 0.792 | 1.0888 |
水溶性 | 微溶 | 互溶 | 不溶 |
实验一:制取苯甲酸甲酯
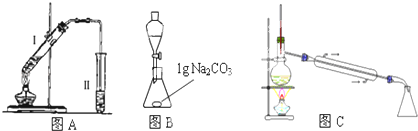
在大试管中加入15g苯甲酸和一定量的甲醇,边振荡边缓慢加入一定量浓硫酸,按图A连接仪器并实验。
(1)苯甲酸与甲醇反应的化学方程式为______________________________________。
(2)中学实验室中制取乙酸乙酯时为了提高酯的产率可以采取的措施有___________________________
实验二:提纯苯甲酸甲酯
该实验要先利用图B装置把图A中制备的苯甲酸甲酯水洗提纯,再利用图C装置进行蒸馏提纯
(3)用图B装置进行水洗提纯时,B装置中固体Na2CO3作用是__________________。
(4)用图C装置进行蒸馏提纯时,当温度计显示____________时,可用锥形瓶收集苯甲酸甲酯。
(5)最终制取15g苯甲酸甲酯,计算得苯甲酸甲酯的产率为______________(小数点后保留1位有效数字)。
【题目】一定条件下,分别向容积固定的密闭容器中充入A和足量B,发生反应如下:2A(g)+B(s)![]() 2D(g)△H<0,测得相关数据如下,分析可知下列说法不正确的是
2D(g)△H<0,测得相关数据如下,分析可知下列说法不正确的是
实验Ⅰ | 实验Ⅱ | 实验Ⅲ | |
反应温度/℃ | 800 | 800 | 850 |
c(A)起始/mol·L-1 | 1 | 2 | 1 |
c(A)平衡/mol·L-1 | .0.5 | 1 | 0.85 |
放出的热量/kJ | a | b | c |
A.实验III的化学平衡常数K<1
B.实验放出的热量关系为b>2a
C.实验III在30min达到平衡时的速率v(A)为0.005mol L-1·min-1
D.当容器内气体密度不随时间而变化时上述反应达到平衡