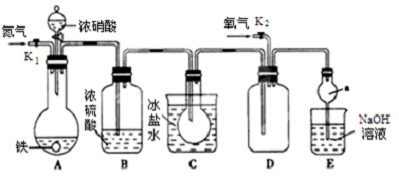
题目内容
5.下列说法中,正确的是( )| A. | AgI、AgCl与水混合后形成的分散系中:c(Ag+)=c(I-)>c(C1-) | |
| B. | 25℃时,在pH相等的NH4C1溶液和盐酸中,水的电离程度也相等 | |
| C. | 25℃时,将pH=11的NaOH溶液与pH=3的某弱酸HA的溶液等体积混合,混合后的溶液呈碱性 | |
| D. | 25℃时,在pH=2的H2C2O4 (一种二元弱酸)溶液与pH=12的NaOH溶液以任意比例混合后形成的溶液中,一定存在:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-) |
分析 A.氯化银的溶解度大于碘化银,则该悬浊液中c(Cl-)>c(I-);
B.酸碱都抑制水的电离;
C.混合后的溶液呈碱性说明碱过量;
D.根据电荷守恒解题.
解答 解:A.AgCl和AgI固体混合物与水形成的悬浊液,由于氯化银的溶解度大于碘化银,则该悬浊液中c(Cl-)>c(I-),所以离子浓度大小为:c(Ag+)>c(Cl-)>c(I-),故A错误;
B.酸碱都抑制水的电离,在pH相等的NH4C1溶液和盐酸中,NH4C1溶液促进水的电离,盐酸抑制水的电离,故B错误;
C.混合后的溶液呈碱性说明碱过量,碱为弱碱,故C错误;
D.根据电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),故D正确.
故选D.
点评 本题考查了离子浓度大小比较、溶液的酸碱性、电荷守恒,试题涉及酸碱混合的定性判断、难溶物溶度积、离子浓度大小等知识,题目难度中等,明确电荷守恒的含义为解答关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.如图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是( )


| A. | 离子半径:M->Z2->Y- | |
| B. | Z元素形成的氧化物都是共价化合物 | |
| C. | 气态氢化物稳定性:Y>Z>M | |
| D. | 三种元素中,M的最高价氧化物对应的水化物酸性最强 |
16.下列指定反应的离子方程式正确的是( )
| A. | 向FeCl3溶液中滴加HI溶液:Fe3++2I-═Fe2++I2 | |
| B. | 向AlCl3溶液中加入过量的氨水:Al3++4NH3•H2O═Al${{O}_{2}}^{-}$+4N${{H}_{4}}^{+}$+2H2O | |
| C. | 向稀NH4HCO3溶液中加入过量NaOH溶液:N${{H}_{4}}^{+}$+OH-═NH3•H2O | |
| D. | 向苯酚钠溶液中通入少量CO2: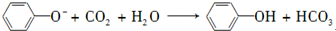 - - |
13.一种抗高血压的药物甲基多巴的结构简式如图所示,下列说法正确的是( )
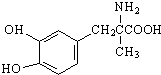

| A. | 1 mol甲基多巴的分子中含有4 mol双键 | |
| B. | 每个甲基多巴分子中含有一个手性碳原子 | |
| C. | 1 mol甲基多巴最多能与2 mol Br2发生取代反应 | |
| D. | 甲基多巴既能与盐酸反应,又能与氢氧化钠溶液反应 |
10.某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成.现进行如图所示实验.
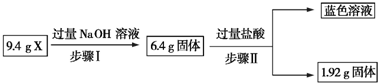
下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | 步骤Ⅰ中减少的3 g固体一定是混合物 | |
| B. | 步骤Ⅱ中质量减少的固体物质一定是Fe2O3 | |
| C. | 根据上述步骤Ⅱ可以得出蓝色溶液中n(Cu2+)=0.02 mol | |
| D. | 根据步骤Ⅰ、Ⅱ可以判断X中氧化铁的质量分数为50% |
14.已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加.相关信息如下表所示,根据推断回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)E在周期表中位于第四周期第ⅠB族
(2)A、B、D三种元素电负性由大到小排列顺序为N>C>Si
(3)A和B的最简单氢化物中沸点较高的NH3.原因是NH3分子间存在氢键.
(4)已知:
①AH4(g)+2BO2(g)-B2(g)+AO2(g)+2H2O(g) H1=-867kJ•mol-1
②2BO2(g)-B2 O4(g) H2=-56.9kJ•mol-1
写出AH4和B2O4反应的热化学方程式CH4(g)+N2O4(g)═N2(g)+CO2(g)+2H2O(g)△H=-810.1kJ/mol.
| A | A的一种单质在自然界中硬度最大 |
| B | B元素的第一电离能比同周期相邻两个元素都大 |
| C | 同周期中,C元素的最高价氧化物对应的水化物的碱性最强 |
| D | D的基态原子M层电子数是K层的2 倍 |
| E | E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满 |
(2)A、B、D三种元素电负性由大到小排列顺序为N>C>Si
(3)A和B的最简单氢化物中沸点较高的NH3.原因是NH3分子间存在氢键.
(4)已知:
①AH4(g)+2BO2(g)-B2(g)+AO2(g)+2H2O(g) H1=-867kJ•mol-1
②2BO2(g)-B2 O4(g) H2=-56.9kJ•mol-1
写出AH4和B2O4反应的热化学方程式CH4(g)+N2O4(g)═N2(g)+CO2(g)+2H2O(g)△H=-810.1kJ/mol.
15.石墨烯的结构示意图如图所示,下列说法正确的是( )
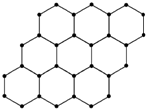

| A. | 石墨烯与石墨互称为同位素 | |
| B. | 12 g石墨烯中约含有6.02×1023个电子 | |
| C. | 石墨烯中可能含有离子键 | |
| D. | 石墨烯中的碳原子间以共价键相结合 |