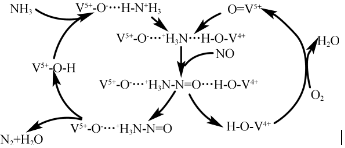
题目内容
9.下列说法正确的是( )| A. | 漂白液中添加醋酸可提高漂白速率 | |
| B. | 石油裂化是为了除去石油中的杂质 | |
| C. | 淀粉溶液可鉴别加碘盐的真伪 | |
| D. | 蛋白质、淀粉、纤维素都能在人体内水解并提供能量 |
分析 A.漂白液中添加醋酸生成HClO;
B.石油裂化得到小分子不饱和烃;
C.碘盐中加碘酸钾;
D.人体内没有纤维素水解需要的酶.
解答 解:A.漂白液中添加醋酸生成HClO,漂白性增强,提高漂白速率,故A正确;
B.石油裂化的目的是为了提高轻质液体燃料(汽油,煤油,柴油等)的产量,特别是提高汽油的产量,不能除杂,故B错误;
C.碘盐中加碘酸钾,淀粉遇碘单质变蓝,则淀粉溶液不能鉴别加碘盐的真伪,故C错误;
D.人体内没有纤维素水解需要的酶,不能提供能量,而蛋白质、淀粉都能在人体内水解并提供能量,故D错误;
故选A.
点评 本题考查物质的性质及化学与生活,为高频考点,把握物质的性质、化学知识在生活中的应用为解答的关键,综合性较强,题目难度不大.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
18.下列烷烃分子中的一个氢原子被氯原子取代后,不能产生同分异构体的是( )
| A. | 戊烷 | B. | 2,2-二甲基丙烷 | C. | 异丁烷 | D. | 异戊烷 |
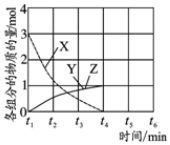
19. 将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是( )
将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是( )
 将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是( )
将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是( )| A. | 阳极产物一定是Cl2,阴极产物一定是Cu | |
| B. | BC段表示在阴极上是H+放电产生了H2 | |
| C. | 整个过程中阳极先产生Cl2,后产生O2 | |
| D. | CD段表示的电解过程中水的电离被促进 |
17.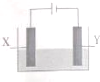 探究电解精炼铜(粗铜含有Ag、Zn、Fe)和电化学腐蚀装置如图,下列叙述正确的是
探究电解精炼铜(粗铜含有Ag、Zn、Fe)和电化学腐蚀装置如图,下列叙述正确的是
( )
 探究电解精炼铜(粗铜含有Ag、Zn、Fe)和电化学腐蚀装置如图,下列叙述正确的是
探究电解精炼铜(粗铜含有Ag、Zn、Fe)和电化学腐蚀装置如图,下列叙述正确的是( )
| A. | 精炼铜时,电解质为硫酸铜溶液.Y电极反应为:Cu2++2e+=Cu | |
| B. | 精炼铜时,溶液中Ag+、Zn2+、Fe2+浓度增大 | |
| C. | X电极为石墨,Y电极为Cu,则铜收到保护 | |
| D. | X电极为Fe,Y电极为Cu,则铁收到保护 |
4.下列说法不正确的是( )
| A. | 碳化硅可作砂纸、砂轮的磨料 | |
| B. | 地沟油没有利用价值,可用燃烧法处理 | |
| C. | 食盐、食醋、纯碱、小苏打是常见的厨房用品 | |
| D. | 开发和利用太阳能是节约化石能源,弥补能源不足的途径 |
1.已知A、B、C、D为短周期元素,请根据下表信息回答问题.
(1)A有8、9、10个中子的三种核素,它们之间称同位素,B在元素周期表的位置:第二周期VA族,B的氢化物水溶液显碱性的原因NH3+H2O=NH3•H2O=NH4++OH-.
(2)C的原子结构示意图为 ,C单质与NaOH溶液反应的离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑.
,C单质与NaOH溶液反应的离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑.
(3)D的单质与A的一种氢化物反应生成具有漂白性的物质,反应的化学方程式为:Cl2+H2O=HCl+HClO.
(4)D的最高价氧化物对应的水化物的分子式为HClO4,其酸性比H2SO4强(填“强”或“弱”).
| 元素 | A | B | C | D |
| 性质或结构信息 | 工业上通过分离液态空气获得其单质,单质能助燃 | 气态氢化物显碱性 | +3价阳离子的核外电子排布与氖原子相同 | 第三周期原子半径最小 |
(2)C的原子结构示意图为
 ,C单质与NaOH溶液反应的离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑.
,C单质与NaOH溶液反应的离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑.(3)D的单质与A的一种氢化物反应生成具有漂白性的物质,反应的化学方程式为:Cl2+H2O=HCl+HClO.
(4)D的最高价氧化物对应的水化物的分子式为HClO4,其酸性比H2SO4强(填“强”或“弱”).
18.下列化学现象的描述正确、解释合理的是( )
| 选项 | 实验 | 现象 | 结论或解释 |
| A | 向溶液中滴加少量氯水,再滴加KSCN溶液 | 溶液变红 | 证明溶液中含有Fe2+ |
| B | 用铜与稀硫酸检验溶液中的 NO3- | 加热后,试管口有红棕色气体产生 | 硝酸根离子在酸性条件下与铜反应生成NO2 |
| C | 将铝箔放在火焰上灼烧 | 熔化物悬挂不下落 | 铝表面生成高熔点氧化铝未熔化 |
| D | 用盐酸标准液滴定未知浓度的Na2CO3溶液 | 分别用甲基橙和酚酞做指示剂时消耗盐酸的体积相等 | 标准液的用量只与待测液的物质的量有关,与指示剂无关 |
| A. | A | B. | B | C. | C | D. | D |
19.第三周期元素的原子中,未成对电子不可能有( )
| A. | 4个 | B. | 3个 | C. | 2个 | D. | 1个 |
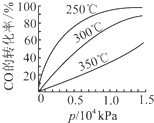 强的关系如图所示.实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,经济效益低.
强的关系如图所示.实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,经济效益低.