题目内容
17.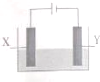 探究电解精炼铜(粗铜含有Ag、Zn、Fe)和电化学腐蚀装置如图,下列叙述正确的是
探究电解精炼铜(粗铜含有Ag、Zn、Fe)和电化学腐蚀装置如图,下列叙述正确的是( )
| A. | 精炼铜时,电解质为硫酸铜溶液.Y电极反应为:Cu2++2e+=Cu | |
| B. | 精炼铜时,溶液中Ag+、Zn2+、Fe2+浓度增大 | |
| C. | X电极为石墨,Y电极为Cu,则铜收到保护 | |
| D. | X电极为Fe,Y电极为Cu,则铁收到保护 |
分析 A、Y电极为阴极,铜的电解精炼是粗铜做阳极,精铜做阴极,铜盐溶液做电解质;
B、精炼铜时,银没有铜活泼,所以单银不放电;
C、X电极为石墨,Y电极为Cu,阴极是溶液中铜离子得到电子生成铜;
D、阳极上铁会失电子生成离子.
解答 解:A、Y电极为阴极,铜的电解精炼是粗铜做阳极,精铜做阴极,铜盐溶液做电解质,所以阴极的电极反应式为:Cu2++2e-=Cu,故A正确;
B、精炼铜时,银没有铜活泼,所以单银不放电,所以溶液中Zn2+、Fe2+浓度增大,故B错误;
C、X电极为石墨,Y电极为Cu,阴极是溶液中铜离子得到电子生成铜,所以保护了铜,故C正确;
D、阳极上铁会失电子生成离子,所以铁腐蚀,故D错误;
故选AC.
点评 本题主要考查电解原理及其应用.电化学原理是高中化学的核心考点,本题利用电解法进行粗铜提纯时粗铜应作阳极,精铜作阴极;阳极与电池的正极相连发生氧化反应,阴极与电池的负极相连发生还原反应;题目难度中等.

练习册系列答案
 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
6.某醇C5H11OH氧化时生成酮,醇脱水仅得一种烯烃,则这种醇的结构简式为( )
| A. | CH3C(CH3)2OH | B. | CH3CHOHCH(CH3)CH3 | ||
| C. | CH3CH2CH2CHOHCH3 | D. | CH3CH2CHOHCH2CH3 |
7.能与KOH的醇溶液发生消去反应的是( )
| A. | (CH3CH2)3CCH2Cl | B. | CH3Cl | C. | 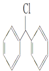 | D. | 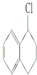 |
5.实验中对某苯的同系物经元素分析测得其分子式为C10H14,经鉴定结构可知分子式中除含苯环外,还含有两个“-CH3”,一个“-CH2-”,一个“CH”,它的可能结构有( )
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 2种 |
12.下列有关说法中错误的是( )
| A. | 用NaOH溶液滴定醋酸时,可用酚酞试液作指示剂 | |
| B. | 花生油、菜子油漕油等水解时可得到一种共同的产物 | |
| C. | NH3+HCl=NH4Cl能自发进行,其△H一定小于零 | |
| D. | 甲烷和氯气反应与苯和硝酸反应的反应类型不同 |
2.萘( )的二氯代物有( )
)的二氯代物有( )
 )的二氯代物有( )
)的二氯代物有( )| A. | 8种 | B. | 10种 | C. | 12种 | D. | 14种 |
9.下列说法正确的是( )
| A. | 漂白液中添加醋酸可提高漂白速率 | |
| B. | 石油裂化是为了除去石油中的杂质 | |
| C. | 淀粉溶液可鉴别加碘盐的真伪 | |
| D. | 蛋白质、淀粉、纤维素都能在人体内水解并提供能量 |
6.已知:99℃时,Kw=1.0×10-12.在该温度下,测得0.1mol.L-1 Na2A溶液pH=6.则下列说法正确的是( )
| A. | H2A在水溶液中的电离方程式为:H2A?2H++A2- | |
| B. | 0.1mol.L-1的H2A溶液pH<2 | |
| C. | 体积相等pH=1的盐酸与H2A溶液分别与足量的Zn反应,H2A溶液产生的H2多 | |
| D. | (NH4)2 A溶液中存在离子浓度关系:c(A2- )>C(NH4+ )>C(H+ )>C(OH- ) |
7.将下列物质分别加入溴水中,不能使溴水褪色的是( )
| A. | Na2SO3晶体 | B. | 乙醇 | C. | C6H6 | D. | Fe |