题目内容
14.雾霾由多种污染物形成,其中包含颗粒物(包括PM2.5在内)、氮氧化物(NOx)、CO、SO2等.化学在解决雾霾污染中有着重要的作用.(1)已知:2SO2(g)+O2(g)═2SO3(g)△H=-196.6kJ•mol-1
2NO(g)+O2(g)═2NO2(g)△H=-113.0kJ•mol-1
则反应NO2(g)+SO2(g)═SO3(g)+NO(g)△H=-41.8kJ•mol-1.
一定条件下,将NO2与SO2以体积比1:2置于恒温恒容的密闭容器中发生上述反应,下列能说明反应达到平衡状态的有b.
a.体系密度保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1mol SO3的同时生成1mol NO2
测得上述反应平衡时NO2与SO2体积比为1:5,则平衡常数K=1.8.
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)═CH3OH(g).CO在不同温度下的平衡转化率与压
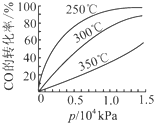 强的关系如图所示.实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,经济效益低.
强的关系如图所示.实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,经济效益低.(3)如图是一种用NH3脱除烟气中NO的原理.
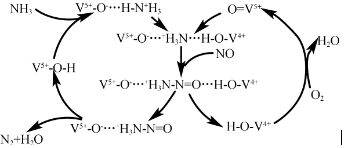
①该脱硝原理中,NO最终转化为H2O和N2(填化学式).
②当消耗1mol NH3和0.5molO2时,除去的NO在标准状况下的体积为11.2 L.
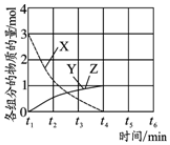
(4)NO直接催化分解(生成N2和O2)也是一种脱硝途径.在不同条件下,NO的分解产物不同.在高压下,NO在40℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如右图所示,写出NO分解的化学方程式3NO$\stackrel{高压}{?}$N2O+NO2.
分析 (1)利用盖斯定律计算反应热,得到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变,计算平衡时各物质的浓度,可K=$\frac{C(SO{\;}_{3})C(NO)}{c(NO{\;}_{2})C(SO{\;}_{2})}$计算平衡常数;
(2)实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是工业生产要考虑速经济效益,要考虑速度和效率,据此分析;
(3)①由图3可知反应物为氧气、一氧化氮和氨气最终生成物为氮气和水;
②根据氨气失去的电子的物质的量等于NO和氧气得到的电子总物质的量计算;
(4)NO在40℃下分解生成两种化合物,根据元素守恒可知生成的为N的氧化物,由图象可知3molNO生成两种氮的氧化物各为1mol,根据原子守恒判断产物书写方程式.
解答 解:(1)2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1①
2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ•mol-1 ②
将方程式$\frac{①-②}{2}$得:NO2(g)+SO2(g)?SO3(g)+NO(g)△H=$\frac{-196.6kJ•mol{\;}^{-1}-(-113.0kJ•mol{\;}^{-1})}{2}$=-41.8kJ/mol,
a.随反应:NO2(g)+SO2(g)?SO3(g)+NO(g)的进行,气体的质量和体积都不变,所以ρ=$\frac{m}{V}$也不变,不能说明到达平衡状态,故a错误;
b.混合气体颜色保持不变,说明二氧化氮的浓度不变,说明到达平衡状态,故b正确;
c.随反应进行,SO3和NO都是生成物,所以体积比一直等于系数比,所以SO3和NO的体积比保持不变,不能说明到达平衡状态,故c错误;
d.每生成1molSO3的同时消耗1molNO2都表示正反应速率,反应自始至终都按此比例进行,故d错误;
NO2(g)+SO2(g)?SO3(g)+NO(g)
起始物质的体积 a 2a 0 0
转化物质的体积 x x x x
平衡物质的体积 a-x 2a-x x x
平衡时NO2与SO2体积比为1:6,即(1a-x):(2a-x)=1:5,故x=$\frac{3}{4}$a,故平衡常数K=$\frac{C(SO{\;}_{3})C(NO)}{c(NO{\;}_{2})C(SO{\;}_{2})}$=$\frac{x{\;}^{2}}{(a-x)(2a-x)}$=$\frac{\frac{9}{16}}{\frac{1}{4}×\frac{5}{4}}$=1.8,
故答案为:-41.8;b;1.8;
(2)实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是工业生产要考虑速经济效益,要考虑速度和效率,压强越大需要的条件越高,花费越大.
故答案为:在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,经济效益低;
(3)①由图3可知反应物为氧气、一氧化氮和氨气最终生成物为氮气和水,所以NO最终转化为N2和H2O,故答案为:N2;
②氧气、一氧化氮和氨气反应生成氮气和水,反应中氨气失去的电子的物质的量等于NO和氧气得到的电子总物质的量,1molNH3转化为N2失去3mol电子,0.5molO2得到2mol电子,则NO转化为N2得到的电子为1mol,所以NO的物质的量为0.5mol,其体积为22.4L/mol×0.5mol=11.2L,故答案为:11.2;
(4)NO在40℃下分解生成两种化合物,根据元素守恒可知生成的为N的氧化物,氮元素的氧化物有NO、N2O、NO2、N2O3、N2O4、N2O5,由图象可知3molNO生成两种氮的氧化物各为1mol,其反应方程式为:3NO=Y+Z,根据原子守恒可知为N2O、NO2,所以方程式为3NO$\stackrel{高压}{?}$ N2O+NO2,故答案为:3NO$\stackrel{高压}{?}$ N2O+NO2.
点评 本题考查了盖斯定律的应用、平衡状态的判断、平衡常数的计算、氧化还原反应化学方程式的书写及其计算、图象的分析与应用等,考查了学生的分析能力以及对基础知识的综合应用能力,题目难度中等.

 活力课时同步练习册系列答案
活力课时同步练习册系列答案| A. | 6种 | B. | 5种 | C. | 4种 | D. | 2种 |
 )的二氯代物有( )
)的二氯代物有( )| A. | 8种 | B. | 10种 | C. | 12种 | D. | 14种 |
| A. | 漂白液中添加醋酸可提高漂白速率 | |
| B. | 石油裂化是为了除去石油中的杂质 | |
| C. | 淀粉溶液可鉴别加碘盐的真伪 | |
| D. | 蛋白质、淀粉、纤维素都能在人体内水解并提供能量 |
| A. | H2A在水溶液中的电离方程式为:H2A?2H++A2- | |
| B. | 0.1mol.L-1的H2A溶液pH<2 | |
| C. | 体积相等pH=1的盐酸与H2A溶液分别与足量的Zn反应,H2A溶液产生的H2多 | |
| D. | (NH4)2 A溶液中存在离子浓度关系:c(A2- )>C(NH4+ )>C(H+ )>C(OH- ) |
| A. | 体积之比13:13:14 | B. | 密度之比14:14:13 | ||
| C. | 质量之比1:1:1 | D. | 原子数之比1:1:1 |
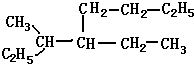 名称:3-甲基-4-乙基-辛烷
名称:3-甲基-4-乙基-辛烷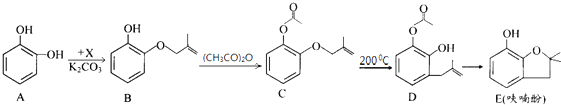
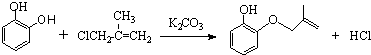 .
. .
. 磷单质及其化合物有广泛应用.
磷单质及其化合物有广泛应用. )之间脱去两个水分子的产物,其结构简式为
)之间脱去两个水分子的产物,其结构简式为 .三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.
.三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.