题目内容
【题目】工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
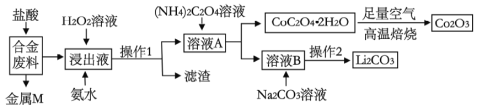
(1)合金废料中加入盐酸浸取,此处盐酸不能换为硝酸,原因是_______________。
(2)操作1用到的玻璃仪器有__________________________。
(3)浸出液中加入H2O2溶液和氨水,应先加入_____________,加入氨水发生反应的离子方程式为____________________。
(4)在空气中焙烧CoC2O4·2H2O的化学方程式是____________________。
(5)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表
温度/℃ | 10 | 30 | 60 | 90 |
浓度/molL-1 | 0.21 | 0.17 | 0.14 | 0.10 |
则操作2的具体流程是_______________、_____________、洗涤、干燥。
【答案】硝酸溶解金属时产生有毒气体,且Cu也溶解在硝酸中 漏斗、烧杯和玻璃棒 H2O2 Fe3++3NH3H2O=Fe(OH)3↓+3NH4+ 4CoC2O42H2O+3O2![]() 2Co2O3+8H2O+8CO2 蒸发浓缩 趁热过滤
2Co2O3+8H2O+8CO2 蒸发浓缩 趁热过滤
【解析】
合金肥料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)加入盐酸过滤得到金属M,M为不与盐酸反应的铜,浸出液中加入过氧化氢,将Fe2+氧化为Fe3+,加入氨水调节溶液pH,使Fe3+转化为Fe(OH)3沉淀,通过操作I过滤得到溶液A,溶液A中加入草酸铵溶液,将Co2+沉淀过滤得到溶液B,B中主要是含Li+的溶液,加入碳酸钠沉淀Li+,过滤得到碳酸锂,结晶析出的CoC2O42H2O在足量空气中煅烧得到氧化钴,以此分析作答。
(1)因为硝酸溶解金属时会生成有毒气体,且Cu也溶解在硝酸中,所以盐酸不能换为硝酸;
(2)操作I为过滤,在过滤的过程中用到的玻璃仪器为漏斗、烧杯和玻璃棒;
(3)加入H2O2的作用是将Fe2+氧化为Fe3+,加入氨水调节溶液pH,使Fe3+转化为Fe(OH)3沉淀,因此先加入H2O2,加入氨水后离子反应为:Fe3++3NH3H2O=Fe(OH)3↓+3NH4+;
(4)CoC2O42H2O在足量空气中煅烧得到氧化钴、CO2和H2O,反应方程式为:4CoC2O42H2O+3O2![]() 2Co2O3+8H2O+8CO2;
2Co2O3+8H2O+8CO2;
(5)根据表格数据可知操作2的具体流程是蒸发浓缩、趁热过滤、洗涤、干燥。

【题目】FeSO4·7H2O广泛用于医药和工业领域,实验室制备FeSO4·7H2O的流程如下:

(1)铁屑与稀硫酸反应前,应用10% Na2CO3溶液浸泡几分钟,操作目的是_________。
(2)最后得到的绿矾晶体用少量冰水洗涤,其目的:①除去晶体表面附着的硫酸等杂质;②_____________________。
(3)FeSO4·7H2O是某些补血剂的主要成分,将1.5 g某补血剂预处理,配成100mL溶液。实验室用KMnO4溶液通过氧化还原滴定测定该补血剂(1.5 g)中铁元素的含量,①配制100 mL 1.200 × 10—2 mol·L—1的KMnO4溶液时,将溶解后的溶液转移至容量瓶中的操作方法是__________________________;
②实验中的KMnO4溶液需要酸化,可用于酸化的酸是_________________。
a. 稀硝酸 b.稀盐酸 c.稀硫酸 d.浓硝酸
KMnO4溶液应盛装在__________滴定管中。滴定到终点时的现象为____________。
③滴定完毕,三次实验记录KMnO4标准溶液的读数如下。
滴定次数实验数据 | 1 | 2 | 3 |
V(样品)/mL | 20.00 | 20.00 | 20.00 |
V(KMnO4)/mL(初读数) | 0.00 | 0.20 | 0.00 |
V(KMnO4)/mL(终读数) | 15.85 | 15.22 | 14.98 |
该补血剂中铁元素的质量分数为_____________________。
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10﹣4molL﹣1 | K1=4.4×10﹣6molL﹣1 K2=5.6×10﹣11molL﹣1 | 3.0×10﹣8 molL﹣1 |
请回答下列问题:
(1)同浓度的CH3COOH、H2CO3、HClO溶液的pH最大的是_____.
(2)常温下0.1molL﹣1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_____(填字母序号,下同).
A.c(H+)
B.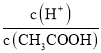
C.c(H+)c(OH﹣)
D.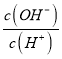
E.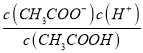
若该溶液升高温度,上述5种表达式的数据增大的是_________.
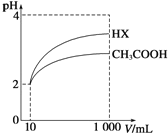
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图:则HX的电离平衡常数_____(填“大于”、“等于”或“小于”)醋酸的平衡常数.稀释后,HX溶液中有水电离出来的c(H+)_____(填“大于”、“等于”或“小于”)醋酸的溶液中有水电离出来的c(H+),理由是___________.
(4)已知100℃时,水的离子积为1×10﹣12,该温度下测得某溶液PH=7,该溶液显_____(填“酸”、“碱”或“中”)性.将此温度下PH=1的H2SO4溶液aL与PH=11的NaOH溶液bL混合,若所得混合液PH=2,则a:b=_____.

