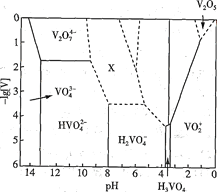
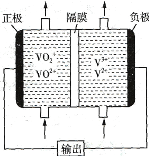
��Ŀ����
����Ŀ��25��ʱ���������ʵĵ���ƽ�ⳣ�������ʾ��
��ѧʽ | CH3COOH | H2CO3 | HClO |
����ƽ�ⳣ�� | 1.7��10��4molL��1 | K1=4.4��10��6molL��1 K2=5.6��10��11molL��1 | 3.0��10��8 molL��1 |
��ش��������⣺
��1��ͬŨ�ȵ�CH3COOH��H2CO3��HClO��Һ��pH������_____��
��2��������0.1molL��1��CH3COOH��Һ�ڼ�ˮϡ�����У����б���ʽ������һ����С����_____������ĸ��ţ���ͬ����
A��c��H+��
B��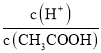
C��c��H+��c��OH����
D��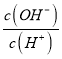
E��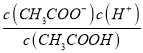
������Һ�����¶ȣ�����5�ֱ���ʽ�������������_________��
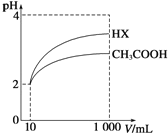
��3�����Ϊ10mL pH=2�Ĵ�����Һ��һԪ��HX��Һ�ֱ��ˮϡ����1000mL��ϡ����pH�仯��ͼ����HX�ĵ���ƽ�ⳣ��_____��������������������������С�����������ƽ�ⳣ����ϡ�ͺ�HX��Һ����ˮ���������c��H+��_____��������������������������С�������������Һ����ˮ���������c��H+����������___________��
��4����֪100��ʱ��ˮ�����ӻ�Ϊ1��10��12�����¶��²��ij��ҺPH=7������Һ��_____�����������������������������ԣ������¶���PH=1��H2SO4��ҺaL��PH=11��NaOH��ҺbL��ϣ������û��ҺPH=2����a��b=_____��
���𰸡�HClO A ABCE ���� ���� HX����ǿ��CH3COOH�ģ�ϡ�ͺ�HX��Һ�е�c��H+��С��CH3COOH��Һ�е�c��H+�����������ˮ�������������Ҳ���� �� 11��9
��������
��ϱ������ݣ���֪����CH3COOH��H2CO3��HClO��HCO3-���μ�����
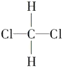
��1��CH3COOH��H2CO3��HClO�������μ�������ͬŨ�ȵ�CH3COOH��H2CO3��HClO��Һ��pH������HClO��
��2��A��0.1mol/L��CH3COOH��Һ��ϡ�����У���Һ��������Ũ�ȼ�С������Aѡ������ȷ�ģ�
B��0.1mol/L��CH3COOH��Һ��ϡ�����У�������Ũ�ȼ�С��ͬʱ����ĵ��������ƶ��� c��H+����С�ij̶�С��CH3COOH�ļ�С�̶ȣ�����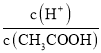 ����B����
����B����
C��![]() ֻ���¶ȵ�Ӱ�죬�¶Ȳ�������ֵ��һ����������C����
ֻ���¶ȵ�Ӱ�죬�¶Ȳ�������ֵ��һ����������C����
D������ϡ�ͣ����Լ����� c��H+����С��ˮ�����ӻ����䣬��c��OH-����������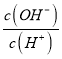 ����D����
����D����
E��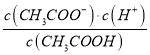 Ϊ����ĵ���ƽ�ⳣ������Ϊ�¶Ȳ��䣬��ˮ�ĵ���ƽ�ⳣ�����䣬��E����
Ϊ����ĵ���ƽ�ⳣ������Ϊ�¶Ȳ��䣬��ˮ�ĵ���ƽ�ⳣ�����䣬��E����
��ˣ�������ȷ���ǣ�A��
������Һ�����¶ȣ����ᡢˮ�ĵ���̶ȶ���������Һ�������ӡ�����������Ũ�ȶ�����
A.�����¶Ⱥ���Һ��������Ũ��c��H+����������Aѡ������ȷ�ģ�
B.�����¶Ⱥ������ӡ�����������Ũ�ȶ����� 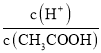 �������Ũ�ȼ�С����ñ�ֵ��������Bѡ������ȷ�ģ�
�������Ũ�ȼ�С����ñ�ֵ��������Bѡ������ȷ�ģ�
C. c��H+��c��OH����Ϊˮ�����ӻ��������¶Ⱥ�ˮ�ĵ���̶�������ˮ�����ӻ���������Cѡ������ȷ�ģ�
D��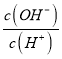 �����¶Ⱥ����������ӡ�������Ũ�ȶ�����������Ũ������ķ��ȴ������������ӣ����Ըñ�ֵ��С����D����
�����¶Ⱥ����������ӡ�������Ũ�ȶ�����������Ũ������ķ��ȴ������������ӣ����Ըñ�ֵ��С����D����
E��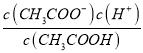 Ϊ����ĵ���ƽ�ⳣ���������¶Ⱥ�����ĵ���ƽ�ⳣ������E��ȷ��
Ϊ����ĵ���ƽ�ⳣ���������¶Ⱥ�����ĵ���ƽ�ⳣ������E��ȷ��
��ˣ�������ȷ���ǣ�ABCE.
(3)����ͼ�����֪������ʼ��������Һ��c��H+����ͬ��c(������)>c(��ǿ��)��ϡ�����н�����ĵ���̶�����������ϡ�����н������c��H+��һֱ���ڽ�ǿ���c��H+����ϡ����ͬ������HX��pH�仯��CH3COOH�Ĵ�HX����ǿ������ƽ�ⳣ����HX����ǿ��CH3COOH�ģ�ϡ�ͺ�HX��Һ��c��H+��С��CH3COOH��Һ�е�c��H+�������Զ�ˮ����������������
(4)100��ʱ��ˮ�����ӻ�Ϊ![]() ��
��![]() ��pH=6��Ϊ������Һ�����¶��²��ij��ҺpH=7������Һ�Լ��ԣ������¶���pH=1��
��pH=6��Ϊ������Һ�����¶��²��ij��ҺpH=7������Һ�Լ��ԣ������¶���pH=1��![]() ��ҺaL��pH=11��NaOH��ҺbL��ϣ������û��ҺpH=2˵����Һ�����ԣ�
��ҺaL��pH=11��NaOH��ҺbL��ϣ������û��ҺpH=2˵����Һ�����ԣ�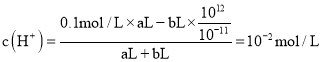 �� a��b=11��9��
�� a��b=11��9��

����Ŀ����ҵ�ϻ�������ij�Ͻ����(��Ҫ��Fe��Cu��Co��Li�ȣ���֪Co��Fe�����еȻ��ý���)�Ĺ����������£�
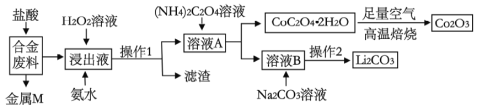
(1)�Ͻ�����м��������ȡ���˴�����ܻ�Ϊ���ᣬԭ����_______________��
(2)����1�õ��IJ���������__________________________��
(3)����Һ�м���H2O2��Һ�Ͱ�ˮ��Ӧ�ȼ���_____________�����백ˮ������Ӧ�����ӷ���ʽΪ____________________��
(4)�ڿ����б���CoC2O4��2H2O�Ļ�ѧ����ʽ��____________________��
(5)��֪Li2CO3����ˮ���䱥����Һ��Ũ�����¶ȹ�ϵ���±�
�¶�/�� | 10 | 30 | 60 | 90 |
Ũ��/molL-1 | 0.21 | 0.17 | 0.14 | 0.10 |
�����2�ľ���������_______________��_____________��ϴ�ӡ����
����Ŀ��ʵ����������ʯ�����Һ����Ҫ��Fe3+������һ������Al3+��Mn2+��Ca2+��Mg2+�ȣ�Ϊԭ���Ʊ��ߴ����������������£�

��֪��������ؽ������������������������pH���±���
�������� | Fe3+ | Fe2+ | Al3+ |
��ʼ������pH | 1.1 | 5.8 | 3.0 |
������ȫ��pH | 3.2 | 8.8 | 5.0 |
��1������ԭ��ʱ��Ӧѡ��_____________������ĸ����
A��Zn�� B��NaClO��Һ C��Fe��
��2��������������Ҫ�ɷֳ���������MnF2�⣬������_____________���ѧʽ����
��3�������̡�ʱ����֪��Ksp(MnS)��4.65��10�C14��Ϊȷ��������ȫ[����Һ��c(Mn2��)��1.0��10�C6 mol��L1]��Ӧ������Һ��c(S2-)��_____________mol��L��1��
��4����������ʱ��������ҺpH�ķ�ΧΪ_____________��
��5����������ʱ����������K2Cr2O7��Һ����Ƿ����δ�������Ľ������ӣ��÷�Ӧ�����ӷ���ʽΪ_____________��
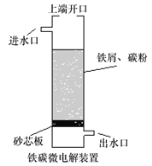
��6����������ʱ����Ӧ�¶�Ϊ85�������£���Ӧʱ��ͷ�Ӧ�յ�pH�����ij����ʵ�Ӱ��ֱ�����ͼ��ʾ������ѵĹ���������_____________��