题目内容
20.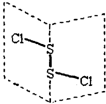 S2Cl2是广泛用于橡胶工业的硫化剂;其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中错误的是( )
S2Cl2是广泛用于橡胶工业的硫化剂;其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中错误的是( )| A. | S2Cl2的电子式为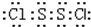 | |
| B. | S2Cl2为含有极性键和非极性键的非极性分子 | |
| C. | S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2 | |
| D. | S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O═SO2↑+3S↓+4HCl |
分析 A.根据结构式知,该分子中每个氯原子和S原子之间形成一个共用电子对、S原子之间形成一个共用电子对,所以每个原子都达到8电子稳定结构;
B.同种非金属元素之间存在非极性键,不同非金属元素之间存在极性键,正负电荷重心重合的分子为非极性分子;
C.分子晶体熔沸点与相对分子质量成正比;
D.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,说明生成二氧化硫,在反应过程中硫元素一部分升高到+4价(生成SO2),S2Cl2中Cl元素化合价为-1价,所以不能再得电子,只能是一部分S元素化合价降低到0价(生成S).
解答 解:A.根据结构式知,该分子中每个氯原子和S原子之间形成一个共用电子对、S原子之间形成一个共用电子对,所以每个原子都达到8电子稳定结构,则该分子电子式为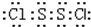 ,故A正确;
,故A正确;
B.S-Cl原子之间存在极性键、S-S原子之间存在非极性键,该分子中正负电荷重心不重合,所以是极性分子,故B错误;
C.分子晶体熔沸点与相对分子质量成正比,S2Br2、S2Cl2都是分子晶体,且相对分子质量S2Br2>S2Cl2,所以熔沸点S2Br2>S2Cl2,故C正确;
D.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,说明生成二氧化硫,在反应过程中硫元素一部分升高到+4价(生成SO2),S2Cl2中Cl元素化合价为-1价,所以不能再得电子,只能是一部分S元素化合价降低到0价(生成S),所以反应方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl,故D正确;
故选B.
点评 本题考查电子式、分子极性、熔沸点高低判断、氧化还原反应等知识点,综合性较强,知道分子晶体熔沸点高低影响因素,易错选项是BD,注意该分子结构特点,不是直线形分子,题目难度不大.

| A. | Ca(HCO3)2 | B. | NaHCO3 | C. | Na2CO3 | D. | CaCO3 |
| A. | 用25mL量筒量取4.0 mol/L的盐酸5.62 mL | |
| B. | 用托盘天平称取5.85 g NaCl固体 | |
| C. | 用蒸发方法使NaCl从溶液中析出时,将蒸发皿中NaCl 溶液全部加热蒸干 | |
| D. | 用500 mL容量瓶可配制450 mL 0.2mol/L H2SO4溶液 |
| A. | Ba2+、C1-、CO32-、K+ | B. | K+、OH-、HCO${\;}_{3}^{-}$、Na+ | ||
| C. | H+、Fe2+、MnO4-、Cl- | D. | Ca2+、HCO${\;}_{3}^{-}$、C1-、K+ |
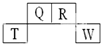 短周期元素Q、R、T、W在元素周期表中的位置如下,其中T原子的M层电子数比K层多2个,下列叙述不正确的是( )
短周期元素Q、R、T、W在元素周期表中的位置如下,其中T原子的M层电子数比K层多2个,下列叙述不正确的是( )| A. | H2R2的分子中既含有极性共价键,又含有非极性共价键 | |
| B. | T的氧化物是一种良好的半导体材料 | |
| C. | Q、R的简单氢化物分子所含质子数、电子数与Ne分子相同 | |
| D. | Q的氢化物与W的氢化物反应有白烟现象,且生成物中既含有离子键,又含有共价键 |