题目内容
15.下列操作中正确的是( )| A. | 用25mL量筒量取4.0 mol/L的盐酸5.62 mL | |
| B. | 用托盘天平称取5.85 g NaCl固体 | |
| C. | 用蒸发方法使NaCl从溶液中析出时,将蒸发皿中NaCl 溶液全部加热蒸干 | |
| D. | 用500 mL容量瓶可配制450 mL 0.2mol/L H2SO4溶液 |
分析 A、量筒量液体只能到小数点后面一位,即量筒只能准确到0.1mL;
B、用托盘天平称取固体只能到小数点后面一位,即天平只能准确到0.1g,
C、蒸发皿中的溶液不能完全蒸干,当大量晶体析出时,要用余热来蒸干;
D、配制450mL0.2mol/LH2SO4溶液时,实验室里没有450mL的容量瓶.
解答 解:A、量筒只能准确到0.1mL,不能量取5.62mL液体,故A错误;
B、天平只能准确到0.1g,用托盘天平称取5.56gKCl固体,故B错误;
C、蒸发皿中的溶液不能完全蒸干,当大量晶体析出时,要用余热来蒸干,故C错误;
D、实验室里没有450mL的容量瓶,要采用500mL的容量瓶,故D正确;
故选D.
点评 本题考查学生常见化学仪器的使用知识,要求学生具备基本的化学实验技能,只有这样才能安全、准确地进行化学实验.

练习册系列答案
相关题目
6.下列反应属于氧化还原反应的是( )
| A. | CaCO3+2HCl=CaCl2+CO2↑+H2O | B. | 2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑ | ||
| C. | CaO+H2O=Ca(OH)2 | D. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ |
3.现有下列物质:①硫酸 ②纯碱 ③豆浆 ④烧碱 ⑤干冰 ⑥氢气.请根据它们的所属类别选择序号填入下表中.
| 类别 | 单质 | 酸 | 碱 | 盐 | 氧化物 | 胶体 |
| 物质 | ⑥ | ① | ④ | ② | ⑤ | ③ |
10.下列说法错误的是( )
| A. | 从1L1mol/L的氯化钠溶液中取出10ml,其浓度仍是1mol/L | |
| B. | 制成0.5L10mol/L的盐酸,需要氯化氢气体112L(标准状况) | |
| C. | 0.5 L 2mol/L的氯化钡溶液中,钡离子和氯离子总数为3×6.02×1023 | |
| D. | 10g 98%硫酸(密度为1.84g/cm3)与10mL18.4mol/L硫酸的浓度是不同的 |
20.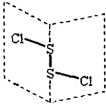 S2Cl2是广泛用于橡胶工业的硫化剂;其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中错误的是( )
S2Cl2是广泛用于橡胶工业的硫化剂;其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中错误的是( )
 S2Cl2是广泛用于橡胶工业的硫化剂;其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中错误的是( )
S2Cl2是广泛用于橡胶工业的硫化剂;其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中错误的是( )| A. | S2Cl2的电子式为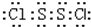 | |
| B. | S2Cl2为含有极性键和非极性键的非极性分子 | |
| C. | S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2 | |
| D. | S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O═SO2↑+3S↓+4HCl |
7.下列叙述正确的是( )
| A. | 1mol SO42-的质量是96 g | B. | 1mol H2O的质量是18 g/mol | ||
| C. | CO2的摩尔质量是44 g | D. | HCl的相对分子质量是36.5 g/mol |
4.工业上将水蒸汽通过炽热的碳层来生产水煤气:H2O+C$\frac{\underline{\;\;△\;\;}}{\;}$CO+H2,在该反应中( )
| A. | C作还原剂 | B. | H2O被氧化 | ||
| C. | 氧元素的化合价降低 | D. | C发生了还原反应 |