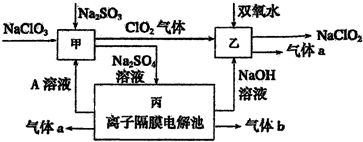
题目内容
9.用双线桥法表示下列反应方程式中电子转移的方向和数目,并指出氧化剂和氧化产物.2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑
氧化剂H2O 氧化产物Cl2.
分析 反应中Cl元素化合价升高,被氧化,氯气为氧化产物,H元素化合价降低,被还原,水为氧化剂,以此解答该题.
解答 解:电解氯化钠溶液时,生成1mol氯气需要2mol电子,生成1mol氢气需要2mol电子,所以其转移电子数是2,电子转移方向和数目为 ,氧化剂为H2O,氧化产物为Cl2,故答案为:
,氧化剂为H2O,氧化产物为Cl2,故答案为: ;H2O;Cl2.
;H2O;Cl2.
点评 本题考查氧化还原反应,侧重于学生的分析能力的考查,为高考常见题型和高频考点,注意从元素化合价的角度分析,能用双线桥标出电子转移的方向和数目,难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
19.下列不能用勒夏特列原理解释的是( )
| A. | 热的纯碱比冷的纯碱去污能力强 | |
| B. | 红棕色NO2加压后颜色先变深后变浅 | |
| C. | SO2催化氧化成SO3的反应,往往需要过量的O2 | |
| D. | H2、I2、HI平衡混和气加压后颜色变深 |
20.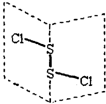 S2Cl2是广泛用于橡胶工业的硫化剂;其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中错误的是( )
S2Cl2是广泛用于橡胶工业的硫化剂;其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中错误的是( )
 S2Cl2是广泛用于橡胶工业的硫化剂;其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中错误的是( )
S2Cl2是广泛用于橡胶工业的硫化剂;其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中错误的是( )| A. | S2Cl2的电子式为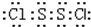 | |
| B. | S2Cl2为含有极性键和非极性键的非极性分子 | |
| C. | S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2 | |
| D. | S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O═SO2↑+3S↓+4HCl |
17.下列对各组物质性质的比较中,正确的是( )
| A. | 硬度:Li>Na>K | |
| B. | 熔点:金刚石>晶体硅>二氧化硅>碳化硅 | |
| C. | 第一电离能:Na<Mg<Al | |
| D. | 空间利用率:六方密堆<面心立方<体心立方 |
4.工业上将水蒸汽通过炽热的碳层来生产水煤气:H2O+C$\frac{\underline{\;\;△\;\;}}{\;}$CO+H2,在该反应中( )
| A. | C作还原剂 | B. | H2O被氧化 | ||
| C. | 氧元素的化合价降低 | D. | C发生了还原反应 |
2.下列物质一定属于同系物的是( )


| A. | ⑦⑧ | B. | ⑤⑦ | C. | ①②③ | D. | ④⑥⑧ |