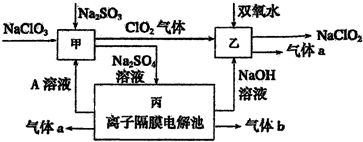
题目内容
12.下列各组离子在溶液中能大量共存的是( )| A. | Ba2+、C1-、CO32-、K+ | B. | K+、OH-、HCO${\;}_{3}^{-}$、Na+ | ||
| C. | H+、Fe2+、MnO4-、Cl- | D. | Ca2+、HCO${\;}_{3}^{-}$、C1-、K+ |
分析 A.钡离子与碳酸根离子反应生成碳酸钡沉淀;
B.氢氧根离子与碳酸氢根离子反应生成碳酸根离子和水;
C.酸性高锰酸根离子能够氧化亚铁离子;
D.四种离子之间不发生反应,能够共存.
解答 解:A.Ba2+、CO32-之间反应生成难溶物碳酸钡,在溶液中不能大量共存,故A错误;
B.OH-、HCO3-之间反应生成碳酸根离子,在溶液中不能大量共存,故B错误;
C.H+、Fe2+、MnO4-之间发生氧化还原反应,在溶液中不能大量共存,故C错误;
D.Ca2+、HCO3-、C1-、K+之间不反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的正误判断,为中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识的能力.

练习册系列答案
相关题目
2.下列反应中,氧化剂与还原剂物质的量之比为1:2的是( )
| A. | 3S+6NaOH═2Na2S+Na2SO3+3H2O | |
| B. | 2CH3COOH+Ca(ClO)2═2HClO+Ca(CH3COO)2 | |
| C. | I2+2NaClO3═2NaIO3+Cl2 | |
| D. | 4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O |
3.现有下列物质:①硫酸 ②纯碱 ③豆浆 ④烧碱 ⑤干冰 ⑥氢气.请根据它们的所属类别选择序号填入下表中.
| 类别 | 单质 | 酸 | 碱 | 盐 | 氧化物 | 胶体 |
| 物质 | ⑥ | ① | ④ | ② | ⑤ | ③ |
20.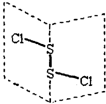 S2Cl2是广泛用于橡胶工业的硫化剂;其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中错误的是( )
S2Cl2是广泛用于橡胶工业的硫化剂;其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中错误的是( )
 S2Cl2是广泛用于橡胶工业的硫化剂;其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中错误的是( )
S2Cl2是广泛用于橡胶工业的硫化剂;其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中错误的是( )| A. | S2Cl2的电子式为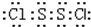 | |
| B. | S2Cl2为含有极性键和非极性键的非极性分子 | |
| C. | S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2 | |
| D. | S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O═SO2↑+3S↓+4HCl |
7.下列叙述正确的是( )
| A. | 1mol SO42-的质量是96 g | B. | 1mol H2O的质量是18 g/mol | ||
| C. | CO2的摩尔质量是44 g | D. | HCl的相对分子质量是36.5 g/mol |
17.下列对各组物质性质的比较中,正确的是( )
| A. | 硬度:Li>Na>K | |
| B. | 熔点:金刚石>晶体硅>二氧化硅>碳化硅 | |
| C. | 第一电离能:Na<Mg<Al | |
| D. | 空间利用率:六方密堆<面心立方<体心立方 |
4.工业上将水蒸汽通过炽热的碳层来生产水煤气:H2O+C$\frac{\underline{\;\;△\;\;}}{\;}$CO+H2,在该反应中( )
| A. | C作还原剂 | B. | H2O被氧化 | ||
| C. | 氧元素的化合价降低 | D. | C发生了还原反应 |