题目内容
5.A、B、C、D、E代表5种元素.请填空:(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为N;
(2)B元素的负一价离子的电子层结构与氩相同,C元素的正一价离子的电子层结构与氙相同,B、C形成的化合物的晶体内每个B离子周围有8个C离子与之紧密相邻.其晶体的主要物理性质有:熔融时能导电、较高的熔点、硬度较大等.(写出两条即可).
(3)D元素的正三价离子的3d亚层为半充满,D元素在周期表中的位置为第四周期 VIII族.
(4)E元素基态原子的M层只有一个能级且全充满,其单质在一定条件下能与干冰反应,试写出该反应的化学方程式2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
分析 (1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,则A有2个电子层,根据基态原子的电子排布式来解答;
(2)根据离子的电子排布知识来确定元素,根据氯化铯晶体结构决定的性质来回答;
(3)根据元素基态原子的核外电子排布知识来回答;
(4)E元素基态原子的M层只有一个能级且全充满,根据元素基态原子的核外电子排布E为Mg,镁和干冰反应生成氧化镁和碳.
解答 解:(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,则A有2个电子层,基态原子的最外层有3个未成对电子,2p轨道上有3个电子,次外层有2个电子,其电子排布式为:1s22s22p3,元素符号为N,
故答案为:N;
(2)B元素的负一价离子的电子层结构与氩相同,所以为Cl-,C元素的正一价离子的电子层结构与氙相同,所以为Cs+,形成的化合物的化学式为CsCl,其结构是立方体结构,其晶体内每个氯离子周围有8个铯离子与之紧相邻,氯化铯属于离子晶体,硬度较大,熔融时能导电,具有较高的熔点,
故答案为:8;熔融时能导电、较高的熔点、硬度较大等;
(3)D元素的正三价离子的3d亚层为半充满,其基态原子的电子排布式为1s22s22p63s23p63d64s2或[Ar]3d64s2,为Fe,在周期表中的位置为第四周期、VIII族,
故答案为:第四周期 VIII族;
(4)E元素基态原子的M层只有一个能级且全充满,则其基态原子的电子排布式为1s22s22p63s2,则E为Mg,镁和干冰反应生成氧化镁和碳:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,
故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
点评 本题考查了元素的推断,主要考查了原子结构和核外电子排布,注意掌握原子核外电子的排布规律,题目难度不大.

| A. | 物质的量浓度为1 mol/L的CuCl2溶液中,含有Cl- 个数为2NA | |
| B. | 若3.01×1023个X原子的质量为8g,则X3气体的摩尔质量是48g/mol | |
| C. | 用特殊方法把固体物质加工到纳米级(1nm~100nm) 的超细粉末粒子,制得纳米材料,纳米材料也是一种胶体 | |
| D. | 在反应2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O中,Cl2 既是氧化剂又是还原剂 |
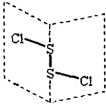 S2Cl2是广泛用于橡胶工业的硫化剂;其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中错误的是( )
S2Cl2是广泛用于橡胶工业的硫化剂;其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中错误的是( )| A. | S2Cl2的电子式为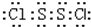 | |
| B. | S2Cl2为含有极性键和非极性键的非极性分子 | |
| C. | S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2 | |
| D. | S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O═SO2↑+3S↓+4HCl |
| A. | NaHSO4═Na++H++SO42- | B. | NaHCO3═Na++H++CO32- | ||
| C. | HCl═H++Cl- | D. | BaSO4═Ba2++SO42- |
| A. | 硬度:Li>Na>K | |
| B. | 熔点:金刚石>晶体硅>二氧化硅>碳化硅 | |
| C. | 第一电离能:Na<Mg<Al | |
| D. | 空间利用率:六方密堆<面心立方<体心立方 |
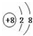 它表示( )
它表示( )| A. | 钠离子 | B. | 氧离子 | C. | 氖原子 | D. | 氧原子 |
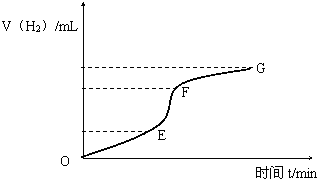 用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:
用纯净的锌粒与稀盐酸反应制取氢气气体,请回答: