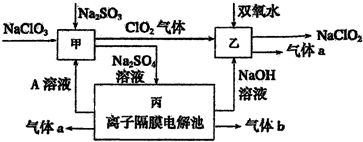
题目内容
13.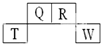 短周期元素Q、R、T、W在元素周期表中的位置如下,其中T原子的M层电子数比K层多2个,下列叙述不正确的是( )
短周期元素Q、R、T、W在元素周期表中的位置如下,其中T原子的M层电子数比K层多2个,下列叙述不正确的是( )| A. | H2R2的分子中既含有极性共价键,又含有非极性共价键 | |
| B. | T的氧化物是一种良好的半导体材料 | |
| C. | Q、R的简单氢化物分子所含质子数、电子数与Ne分子相同 | |
| D. | Q的氢化物与W的氢化物反应有白烟现象,且生成物中既含有离子键,又含有共价键 |
分析 T原子的M层电子数比K层多2个,M层电子数为2+2=4,则T为Si;由元素在元素周期表中的位置可知,Q为N、R为O、W为Cl,据此解答.
解答 解:T原子的M层电子数比K层多2个,M层电子数为2+2=4,则T为Si;由元素在元素周期表中的位置可知,Q为N、R为O、W为Cl,
A.H2O2的分子中O原子与H原子之间形成极性键,O原子之间形成非极性键,故A正确;
B.Si单质是一种良好的半导体材料,Si的氧化物二氧化硅是制造光导纤维的材料,故B错误;
C.N、O的简单氢化物分别为NH3、H2O,分子所含质子数、电子数均为10,与Ne分子相同,故C正确;
D.氨气与HCl反应生成氯化铵,有白烟现象,氯化铵中既含有离子键,又含有共价键,故D正确,
故选B.
点评 本题考查结构性质位置关系应用,明确元素是解题关键,侧重对基础知识的巩固,题目难度不大.

练习册系列答案
相关题目
20.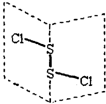 S2Cl2是广泛用于橡胶工业的硫化剂;其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中错误的是( )
S2Cl2是广泛用于橡胶工业的硫化剂;其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中错误的是( )
 S2Cl2是广泛用于橡胶工业的硫化剂;其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中错误的是( )
S2Cl2是广泛用于橡胶工业的硫化剂;其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中错误的是( )| A. | S2Cl2的电子式为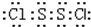 | |
| B. | S2Cl2为含有极性键和非极性键的非极性分子 | |
| C. | S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2 | |
| D. | S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O═SO2↑+3S↓+4HCl |
8.下列文字表述与对应的化学用语或名称关系正确的是( )
①131I与127I两核素互为同素异形体
②聚乙烯的结构简式为
③水晶的分子式为SiO2
④次氯酸分子的电子式为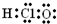
⑤新戊烷的系统命名为2,2-二甲基丙烷
⑥光气(COCl2)结构式为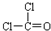
⑦苯分子的比例模型为
⑧NaH中阴离子的结构示意图
①131I与127I两核素互为同素异形体
②聚乙烯的结构简式为

③水晶的分子式为SiO2
④次氯酸分子的电子式为
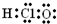
⑤新戊烷的系统命名为2,2-二甲基丙烷
⑥光气(COCl2)结构式为
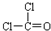
⑦苯分子的比例模型为

⑧NaH中阴离子的结构示意图

| A. | ①③④⑧ | B. | ②⑤⑥⑦ | C. | ②③⑤⑥⑦ | D. | ②④⑤⑥⑧ |
18.某微粒的结构示意图为 它表示( )
它表示( )
 它表示( )
它表示( )| A. | 钠离子 | B. | 氧离子 | C. | 氖原子 | D. | 氧原子 |
2.下列物质一定属于同系物的是( )


| A. | ⑦⑧ | B. | ⑤⑦ | C. | ①②③ | D. | ④⑥⑧ |
3.设NA为阿伏加德罗常数,下列说法中正确的是( )
| A. | 1000mL0.1mol/L 的NaCl溶液中,Na+与Cl-离子总数为0.2NA | |
| B. | 2NA个二氧化碳分子的质量为44g | |
| C. | NA个氢气分子所占的体积为22.4L | |
| D. | 17g氨气中所含原子数为NA |