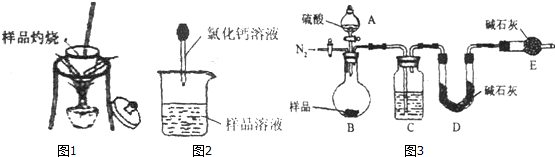
题目内容
8.现有失去标签的四瓶无色溶液A、B、C、D,只知它们是K2CO3、K2SO4、NaHSO4和Ba(OH)2,为鉴别它们,进行如下实验:①A+D→溶液+气体②B+C→溶液+沉淀
③B+D→溶液+沉淀④A+B→溶液+沉淀
⑤向④得到的沉淀中加入过量溶液D,产生无色无味的气体,同时还有沉淀存在.
根据以上实验事实,请回答下列问题:
(1)①中产生的气体的化学式(分子式)为CO2.
(2)A、D溶液分别为:K2CO3、NaHSO4.
(3)Ba(OH)2在水溶液中的电离方程式为Ba(OH)2=Ba2++2OH-
(4)写出下列反应的离子方程式:
①A+D:CO32-+2H+=CO2↑+H2O
②B+C:Ba2++SO42-=BaSO4↓
(5)写出B+D反应后溶液呈中性的化学方程式:Ba(OH)2+2NaHSO4=BaSO4↓+Na2SO4+2H2O.
分析 根据②③④中B与C、D、A反应均得到沉淀,可知B为Ba(OH)2,只有NaHSO4和K2CO3反应才能生成气体,根据①可知,A和D应该是K2CO3和NaHSO4,则C为K2SO4,将④得到的沉淀中加入过量溶液D,产生无色无味的气体,同时还有沉淀存在,说明④中的沉淀是BaCO3,所以A是K2CO3,D是NaHSO4,据此解答.
解答 解:根据②③④中B与C、D、A反应均得到沉淀,可知B为Ba(OH)2,只有NaHSO4和K2CO3反应才能生成气体,根据①可知,A和D应该是K2CO3和NaHSO4,则C为K2SO4,将④得到的沉淀中加入过量溶液D,产生无色无味的气体,同时还有沉淀存在,说明④中的沉淀是BaCO3,所以A是K2CO3,D是NaHSO4.
(1)①中产生的气体的化学式(分子式)为 CO2,故答案为:CO2;
(2)A、D溶液分别为:K2CO3、NaHSO4,故答案为:K2CO3;NaHSO4;
(3)Ba(OH)2在水溶液中的电离方程式为:Ba(OH)2=Ba2++2OH-,故答案为:Ba(OH)2=Ba2++2OH-;
(4)反应①为K2CO3和NaHSO4的反应,反应的方程式为:CO32-+2H+=CO2↑+H2O,
反应②为Ba(OH)2与K2SO4反应,反应的离子方程式为:Ba2++SO42-=BaSO4↓,
故答案为:CO32-+2H+=CO2↑+H2O;Ba2++SO42-=BaSO4↓;
(5)Ba(OH)2与NaHSO4反应后溶液呈中性,二者按1:2反应,反应化学方程式:Ba(OH)2+2NaHSO4=BaSO4↓+Na2SO4+2H2O,
故答案为:Ba(OH)2+2NaHSO4=BaSO4↓+Na2SO4+2H2O.
点评 本题考查无机物推断,属于实验推断型,根据反应现象进行推断,需要学生熟练掌握元素化合物性质与反应现象,较好的考查学生分析推理能力,难度中等.

| A. | 298K时,CaSO4的溶解度约为7.00×10-2mol/L | |
| B. | 反应CaSO4(s)+CO32-=CaCO3(s)+SO42-在298K时的平衡常数K=Ksp(CaSO4)/Ksp(CaCO3)=1.75×104 | |
| C. | CaCO3、CaSO4的饱和溶液的导电能力很弱,所以它们都是弱电解质 | |
| D. | 升高温度,两种盐的溶度积与溶解度都保持不变 |
| A. | 热的纯碱比冷的纯碱去污能力强 | |
| B. | 红棕色NO2加压后颜色先变深后变浅 | |
| C. | SO2催化氧化成SO3的反应,往往需要过量的O2 | |
| D. | H2、I2、HI平衡混和气加压后颜色变深 |
| 类别 | 单质 | 酸 | 碱 | 盐 | 氧化物 | 胶体 |
| 物质 | ⑥ | ① | ④ | ② | ⑤ | ③ |
| A. | 物质的量浓度为1 mol/L的CuCl2溶液中,含有Cl- 个数为2NA | |
| B. | 若3.01×1023个X原子的质量为8g,则X3气体的摩尔质量是48g/mol | |
| C. | 用特殊方法把固体物质加工到纳米级(1nm~100nm) 的超细粉末粒子,制得纳米材料,纳米材料也是一种胶体 | |
| D. | 在反应2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O中,Cl2 既是氧化剂又是还原剂 |
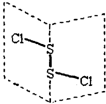 S2Cl2是广泛用于橡胶工业的硫化剂;其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中错误的是( )
S2Cl2是广泛用于橡胶工业的硫化剂;其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中错误的是( )| A. | S2Cl2的电子式为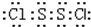 | |
| B. | S2Cl2为含有极性键和非极性键的非极性分子 | |
| C. | S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2 | |
| D. | S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O═SO2↑+3S↓+4HCl |
| A. | 硬度:Li>Na>K | |
| B. | 熔点:金刚石>晶体硅>二氧化硅>碳化硅 | |
| C. | 第一电离能:Na<Mg<Al | |
| D. | 空间利用率:六方密堆<面心立方<体心立方 |