题目内容
13.为验证氧化性Cl2>Fe3+>SO2,某小组用如图1所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验).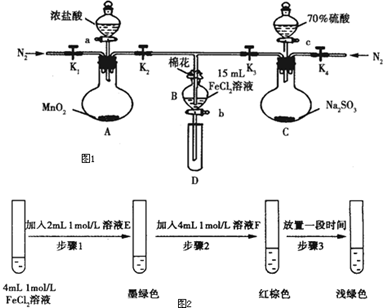
实验过程:
Ⅰ.打开弹簧夹K1~K4,通过一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K2、K4.
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2.
Ⅳ.打开活塞b,使约2ml的溶液流入D试管中,检验其中的离子.
Ⅴ.打开弹簧夹K2,活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K2.
Ⅵ.更换试管D,重复过程Ⅳ,检验B溶液中的离子.
(1)过程Ⅰ的目的是排出装置中的空气,防止干扰实验.
(2)棉花中浸润的溶液为NaOH溶液.
(3)A中发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是70%硫酸中氢离子浓度大于98%的硫酸,因此反应速率更快.
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是乙、丙(填“甲”、“乙”或“丙”).
| 过程Ⅳ:B溶液中含有的离子 | 过程Ⅵ:B溶液中含有的离子 | |
| 甲 | 有Fe3+,无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+、又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+、无Fe2+ | 有Fe2+ |
查阅资料:Fe2+(aq)+2SO32-(aq)?FeSO3(s)(墨绿色)
提出假设:FeCl2与SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色.
某同学设计如图2实验,证实该假设成立:
①溶液E和F分别为Na2SO3、FeCl3.
②请用离子方程式解释步骤3中溶液(酸性)由红棕色变浅绿色的原因Fe3+消耗SO32-,c(SO32-)减小,平衡Fe2+(aq)+SO32-(aq)?FeSO3(s)(墨绿色)逆向移动,溶液颜色由红棕色变为浅绿色.
分析 (1)空气中氧气具有氧化性,能干扰实验;
(2)氯气、二氧化硫都有毒,不能直接排空,且氯气、二氧化硫都能和NaOH溶液反应生成无毒物质,可以用碱液吸收;
(3)加热条件下,浓盐酸和二氧化锰反应生成氯化锰、氯气和水;
(4)溶液中氢离子浓度越大反应速率越快;
(5)溶液显酸性,检验SO42-应选择BaCl2溶液;乙中第一次,说明Cl2不足,Cl2氧化性大于Fe3+,第二次有SO42-,说明发生SO2与Fe3+的反应,则氧化性Fe3+>SO2;丙中第一次有Fe3+,无Fe2+,则氧化性Cl2>Fe3+,第二次有Fe2+,说明发生SO2与Fe3+的反应,则氧化性Fe3+>SO2;
(6)增大反应物浓度平衡向正反应方向移动,减小反应物浓度,平衡逆向移动,根据混合物颜色变化判断.
解答 解:(1)空气中氧气具有氧化性,能氧化亚铁离子生成铁离子而干扰实验,为排除氧气的干扰,用氮气将装置中的空气排出,故答案为:排出装置中的空气,防止干扰实验;
(2)氯气、二氧化硫都有毒,不能直接排空,氯气和水反应生成酸、二氧化硫属于酸性氧化物,所以氯气、二氧化硫都能和NaOH溶液反应生成无毒物质,可以用碱液吸收,则棉花浸润的液体是NaOH溶液,
故答案为:NaOH溶液;
(3)加热条件下,浓盐酸和二氧化锰反应生成氯化锰、氯气和水,反应方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(4)溶液中氢离子浓度越大反应速率越快,98%浓硫酸中氢离子浓度小于70%硫酸,所以70%硫酸反应速率较快,故答案为:70%硫酸中氢离子浓度大于98%的硫酸,因此反应速率更快;
(5)溶液显酸性,检验SO42-应选择BaCl2溶液;乙中第一次,说明Cl2不足,Cl2氧化性大于Fe3+,第二次有SO42-,说明发生SO2与Fe3+的反应,则氧化性Fe3+>SO2;丙中第一次有Fe3+,无Fe2+,则氧化性Cl2>Fe3+,第二次有Fe2+,说明发生SO2与Fe3+的反应,则氧化性Fe3+>SO2,
故答案为:乙、丙;
(6)①根据已知条件:FeCl3与SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色,所以可以借助氯化铁和亚硫酸钠溶液来确定假设是否成立,故答案为:Na2SO3;FeCl3;
②根据化学平衡:Fe2+(aq)+SO32-(aq)?FeSO3(s)(墨绿色),步骤3中,Fe3+消耗SO32-,c(SO32-)减小,平衡逆向移动,溶液颜色由红棕色变为浅绿色,
故答案为:Fe3+消耗SO32-,c(SO32-)减小,平衡Fe2+(aq)+SO32-(aq)?FeSO3(s)(墨绿色)逆向移动,溶液颜色由红棕色变为浅绿色.
点评 本题考查性质实验方案设计,为高频考点,涉及实验基本操作过程、化学平衡移动原理、物质的制备、化学反应速率影响因素等知识点,明确实验原理是解本题关键,注意氧化性强弱比较是解答难点,注意(4)题氢离子浓度影响反应速率,为易错点.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 1/22.4mol/L | B. | V/33.6mol/L | C. | V/22.4mol/L | D. | 1/33.6mol/L |
| A. | 1.0 mol/L的CH3COOH溶液:K+、Fe3+、NO3-、Cl- | |
| B. | l.0 mol•L-1 NaClO溶液:Fe2+、K+、I-、Cl- | |
| C. | 甲基橙显黄色的溶液:Na+、CO32-、NO3-、SO32- | |
| D. | 在c(OH-)/c(H+)=1×1013的溶液:NH4+、Ca2+、C1-、K+ |
(1)用固体NaHCO3配置饱和NaHCO3溶液的操作过程在烧杯中加入足量的碳酸氢钠固体,加入适量蒸馏水,加热使之溶解,冷却后取上层清液即可.饱和NaHCO3溶液pH=8.4,用离子方程式表示HCO3-+H2O?H2CO3+OH-.
(2)请完成以下实验设计(镁条已擦去氧化膜且表面积大致相同.表中不要留空格):
| 序号 | 实验操作 | 实验现象 | 实验结论 |
| ① | 将镁条投入5mL蒸馏水 | 微量气泡 | Mg与蒸馏水缓慢反应 |
| ② | 将镁条投入5mL饱和NaHCO3溶液中 | 镁表面出现大量气泡 | Mg与NaHCO3溶液剧烈反应 |
| ③ | 将镁条投入5mLNaOH溶液中 | 现象不明显 | Mg与NaOH溶液较难反应 |
请假设实验,用镁条和饱和NaHCO3溶液制取气体并检验其中是否含有CO2,写出实验步骤和结论.
| 实验步骤 | 想象和结论 |
| 大试管中加入擦去氧化膜的镁条 |
①离子化合物一定含离子键,也可能含共价键
②共价化合物一定含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥熔融状态能导电的化合物一定是离子化合物.
| A. | ①③⑤ | B. | ②④⑥ | C. | ②③④ | D. | ①③⑥ |
| A. | 1.0 mol | B. | 1.5 mol | C. | 2.0 mol | D. | 2.5 mol |