题目内容
19.在标准状况下,在一个容积为V L的圆底烧瓶中收集满氨气,配上塞子、导管等进行喷泉实验,烧瓶中溶液的物质的量浓度为( )| A. | 1/22.4mol/L | B. | V/33.6mol/L | C. | V/22.4mol/L | D. | 1/33.6mol/L |
分析 氨气溶于水,溶液体积等于氨气体积,圆底烧瓶的容积为VL,则氨气和溶液的体积为VL,根据n=$\frac{V}{{V}_{m}}$计算氨气的物质的量,再根据c=$\frac{n}{V}$计算溶液的物质的量浓度.
解答 解:氨气极易溶于水,圆底烧瓶的容积为VL,则氨气和溶液的体积为VL,
标况下VL氨气的物质的量为:$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,
所得溶液的物质的量浓度为:c=$\frac{\frac{V}{22.4}mol}{VL}$=$\frac{1}{22.4}$mol/L,
故选A.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量浓度的概念及表达式为解答关键,试题培养了学生的分析能力及灵活应用基础知识的能力.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
9.根据如表短周期元素性质的数据判断,下列说法正确的是( )
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径/10-10 m | 0.66 | 1.36 | 1.23 | 1.10 | 0.99 | 1.54 | 0.70 | 1.18 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
| A. | 最高价氧化物的水化物酸性:④>⑤ | B. | 与水反应的剧烈程度:②>⑥ | ||
| C. | 气态氢化物的稳定性:④>⑦ | D. | ①⑥⑦形成的化合物是离子化合物 |
10.对于反应2H2O2═2H2O+O2↑,下列措施能加快该反应速率的是( )
| A. | 减小压强 | B. | 加热 | C. | 加水稀释 | D. | 降低温度 |
7.为了探究影响化学反应速率的因素,4位同学分别设计了下列4个实验,其中结论不正确的是( )
| A. | 将大小、形状相同的镁条和铝条与相同浓度、相同温度下的盐酸反应时,两者快慢相同 | |
| B. | 盛有相同浓度双氧水的两支试管,一支加入MnO2放在冷水中,一支直接放在冷水中,前者反应快 | |
| C. | 将浓硝酸分别放在冷暗处和强光下,发现强光下的浓硝酸分解得快 | |
| D. | 升高温度,H2O2的分解速率加快,原因是反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多 |
14.下列化合物不能由单质直接生成的是( )
| A. | FeS | B. | CuS | C. | CuCl2 | D. | FeCl3 |
11.下列离子方程式书写不正确的是( )
| A. | 氯水和碘化钾反应:Cl2+2I-=2Cl-+I2 | |
| B. | 盐酸与AgNO3溶液反应:HCl+Ag+=H++Ag Cl↓ | |
| C. | 氢氧化钙溶液吸收氯气:Cl2+2OH-=Cl-+ClO-+H2O | |
| D. | 二氧化锰和盐酸制氯气:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O |
8.液态锂离子电池是指Li+嵌入化合物为正负电极的二次电池.正极采用锂化合物LiCoO2,负极采用碳电极,充电后成为锂-碳层间化合物LixC6(0<x≤1),电解质为溶解有锂盐LiPF6、LiAsF6等的有机溶液.下列有关说法不正确的是( )
| A. | 将LiCoO2改写成为氧化物的形式为Li2O•Co2O3 | |
| B. | 该电池的电解液必须使用有机溶剂主要是由于有机溶剂有良好的导电性 | |
| C. | Li是3号元素,是最轻的金属之一,这类电池质能比高 | |
| D. | 在电池充放电时,Li+在两个电极之间往返嵌入和脱嵌.该电池的充放电反应方程式为:LiCoO2+6C$?_{放电}^{充电}$Li1-xCoO2+LixC6 |
13.为验证氧化性Cl2>Fe3+>SO2,某小组用如图1所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验).
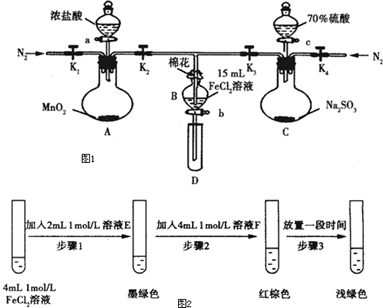
实验过程:
Ⅰ.打开弹簧夹K1~K4,通过一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K2、K4.
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2.
Ⅳ.打开活塞b,使约2ml的溶液流入D试管中,检验其中的离子.
Ⅴ.打开弹簧夹K2,活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K2.
Ⅵ.更换试管D,重复过程Ⅳ,检验B溶液中的离子.
(1)过程Ⅰ的目的是排出装置中的空气,防止干扰实验.
(2)棉花中浸润的溶液为NaOH溶液.
(3)A中发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是70%硫酸中氢离子浓度大于98%的硫酸,因此反应速率更快.
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是乙、丙(填“甲”、“乙”或“丙”).
(6)进行实验过程Ⅴ时,B中溶液颜色由黄色逐渐变为红棕色,停止通气,放置一段时间后溶液颜色变为浅绿色.
查阅资料:Fe2+(aq)+2SO32-(aq)?FeSO3(s)(墨绿色)
提出假设:FeCl2与SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色.
某同学设计如图2实验,证实该假设成立:
①溶液E和F分别为Na2SO3、FeCl3.
②请用离子方程式解释步骤3中溶液(酸性)由红棕色变浅绿色的原因Fe3+消耗SO32-,c(SO32-)减小,平衡Fe2+(aq)+SO32-(aq)?FeSO3(s)(墨绿色)逆向移动,溶液颜色由红棕色变为浅绿色.

实验过程:
Ⅰ.打开弹簧夹K1~K4,通过一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K2、K4.
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2.
Ⅳ.打开活塞b,使约2ml的溶液流入D试管中,检验其中的离子.
Ⅴ.打开弹簧夹K2,活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K2.
Ⅵ.更换试管D,重复过程Ⅳ,检验B溶液中的离子.
(1)过程Ⅰ的目的是排出装置中的空气,防止干扰实验.
(2)棉花中浸润的溶液为NaOH溶液.
(3)A中发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是70%硫酸中氢离子浓度大于98%的硫酸,因此反应速率更快.
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是乙、丙(填“甲”、“乙”或“丙”).
| 过程Ⅳ:B溶液中含有的离子 | 过程Ⅵ:B溶液中含有的离子 | |
| 甲 | 有Fe3+,无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+、又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+、无Fe2+ | 有Fe2+ |
查阅资料:Fe2+(aq)+2SO32-(aq)?FeSO3(s)(墨绿色)
提出假设:FeCl2与SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色.
某同学设计如图2实验,证实该假设成立:
①溶液E和F分别为Na2SO3、FeCl3.
②请用离子方程式解释步骤3中溶液(酸性)由红棕色变浅绿色的原因Fe3+消耗SO32-,c(SO32-)减小,平衡Fe2+(aq)+SO32-(aq)?FeSO3(s)(墨绿色)逆向移动,溶液颜色由红棕色变为浅绿色.