题目内容
2.用NaOH固体配制250mL 0.2mol•L-1 NaOH溶液.(1)经计算需用NaOH固体2.0 g
(2)配制该溶液用到的仪器有除托盘天平、烧杯、玻璃棒、量筒外,还有250mL容量瓶;
(3)容量瓶上标有以下五项中的①③⑤(填序号)
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(4)配制溶液时,正确的操作顺序是(用字母表示,每个字母只能用一次)B、C、A、F、E;并完成横线上的内容.
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用天平准确称取所需质量的NaOH,放入烧杯,加入少量水(约30mL),用玻璃棒慢慢搅拌,使其充分溶解
C.将已冷却的NaOH溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹液面与刻度线相切.
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(5)在配制上述溶液实验中,下列操作引起结果(浓度)偏低的有AB(填序号).
A.没有用蒸馏水洗烧杯2~3次,未将洗液移人容量瓶中
B.定容时,加水超过了刻度线,倒出一些再重新加水到刻度线
C.容量瓶刚用蒸馏水洗净,没有烘干.
分析 (1)利用n=cv计算出氢氧化钠的物质的量,再根据m=nM计算所需氢氧化钠的质量;
(2)根据实验目的,选择实验仪器;
(3)根据容量瓶分析;
(4)根据配制溶液的实验操作过程进行实验步骤排序;
(5)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=nVnV分析判断.
解答 解:(1)需氢氧化钠的质量为m=0.25L×0.2mol•L-1×40g/mol=2.0g,故答案为:2.0;
(2)配制该溶液用到的仪器有除托盘天平、烧杯、玻璃棒、量筒外,还有250mL容量瓶,故答案为:250mL容量瓶;
(3)容量瓶上标有温度、刻度线、容量,故答案为:①③⑤;
(4)操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,直到凹液面与刻度线相切,最后定容颠倒摇匀;
故答案为:B、C、A、F、E;玻璃棒;凹液面与刻度线相切;
(5)A. 没有用蒸馏水洗烧杯2~3次,未将洗液移人容量瓶中,移入容量瓶中氢氧化钠的实际质量减小,溶液浓度偏低;
B. 定容时,加水超过了刻度线,倒出一些再重新加水到刻度线,移入容量瓶中氢氧化钠的实际质量减小,溶液浓度偏低;
C.最后需要定容,容量瓶不干燥,含有少量蒸馏水,对溶液浓度无影响;
故选AB.
点评 本题考查了一定物质的量浓度溶液的配制,注意从c=nVnV理解配制原理,注意腐蚀性易潮解的药品应放在玻璃器皿内称量.

练习册系列答案
相关题目
4.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 常温常压下,3.0g含甲醛的冰醋酸中含有的原子总数为0.4 NA | |
| B. | 标准状况下,2.24L苯中含有的C-H键的数目为0.6NA | |
| C. | 1 L 0.01 mol•L-1 KAl(SO4)2溶液中,含有的阳离子数目为0.02NA | |
| D. | 反应KIO3+6HI=3I2+KI+3H2O,每生成1.5mol I2转移电子数为3NA |
13.有关下列装置或操作的说法正确的是( )
| A. | 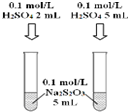 可以探究H2SO4浓度对反应速率的影响 | |
| B. | 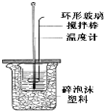 用于测定中和热时应该用稍过量的NaOH溶液和盐酸反应 | |
| C. | 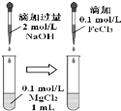 可以探究Mg(OH)2能否转化成Fe(OH)3 | |
| D. | 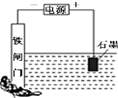 中金属防护方法叫做牺牲阳极的阴极保护法 |
17.下列现象说法正确的是( )
| A. | 红热的铁丝在氯气中燃烧产生棕色的烟雾 | |
| B. | 含有氯元素的物质都呈黄绿色 | |
| C. | 氢气在氯气中燃烧时火焰呈淡蓝色,在瓶口有白雾产生 | |
| D. | 钠在空气里加热,先熔成小球,剧烈燃烧,产生黄色火焰,生成淡黄色固体 |
7.下列物质性质与应用对应关系正确的是( )
| A. | 氯化镁属于电解质,工业上可用电解其溶液的方法制镁 | |
| B. | 钠钾合金的硬度小,可用作快中子反应堆的热交换剂 | |
| C. | Fe2O3是红棕色固体,可以制成红色的油漆、涂料 | |
| D. | 溴单质在CCl4中的溶解度大,可用CCl4萃取Br- |
14.下列实验操作中,能达到相应实验目的是( )
| 选项 | 实验操作 | 实验目的 |
| A | 将NaOH溶液滴入某溶液中,加热,放出的气体 能使湿润的红色石蕊试纸变蓝 | 证明该溶液中存在NH4+ |
| B | 向某溶液中加入稀盐酸,放出无色气体,将气体通入 澄清石灰水,石灰水变浑浊 | 证明该溶液中存在CO32- |
| C | 将Cl2通入品红溶液中,品红溶液褪色 | 证明Cl2具有漂白性 |
| D | 将酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 证明H2O2氧化性比Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
11.各可逆反应达平衡后,改变反应条件,其变化趋势正确的是( )
| A. | 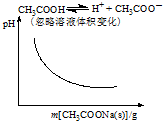 | B. | 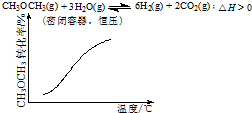 | ||
| C. |  | D. | 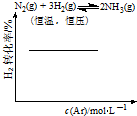 |
12.将2mol A和1mol B充入到绝热恒容密闭容器中,发生反应2A(g)+B(g)═3C(g)+D(s),达到平衡时测得容器内压强增大.若该反应在恒温恒容的密闭容器中进行,下列有关说法正确的是( )
| A. | 平衡前,随着反应的进行,容器内压强始终不变 | |
| B. | 平衡时,分离出少量D,A的转化率提高 | |
| C. | 平衡时,升高温度,容器内混合气体的密度减小 | |
| D. | 平衡时,充入C,该反应平衡常数减小 |
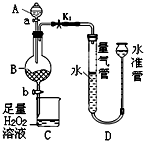 工业生产中会产生大量的废铁屑,可将其“变废为宝”制成化工原料氯化铁.实验室中利用如图所示装置探究由废铁屑制备FeCl3•6H2O晶体的原理并测定铁屑中铁单质的质量分数(杂质不溶于水且不与酸反应).
工业生产中会产生大量的废铁屑,可将其“变废为宝”制成化工原料氯化铁.实验室中利用如图所示装置探究由废铁屑制备FeCl3•6H2O晶体的原理并测定铁屑中铁单质的质量分数(杂质不溶于水且不与酸反应).