题目内容
17. 往1.0mol•L-1KI溶液中加入固体I2,发生反应:I2(aq)+I- (aq)═I3-(aq)△H;I-的物质的量浓度c(I-)随温度T的变化曲线如图所示.已知反应第一次达到平衡时用时10s,则下列说法正确的是( )
往1.0mol•L-1KI溶液中加入固体I2,发生反应:I2(aq)+I- (aq)═I3-(aq)△H;I-的物质的量浓度c(I-)随温度T的变化曲线如图所示.已知反应第一次达到平衡时用时10s,则下列说法正确的是( )| A. | 该反应的△H>0 | |
| B. | a、c两点对应的I-反应速率相等 | |
| C. | b点时0~10s I-的平均反应速率为0.04mol•L-1•s-1 | |
| D. | d点时该反应在对应温度下处于平衡状态 |
分析 平衡状态是反应进行的最大限度,所以b点是平衡状态,c(I-)从1~0.4时是平衡的建立,而b点后是温度的改变平衡的移动,由此分析解答.
解答 解:A、b点后是温度升高,而平衡逆向移动,所以正反应是放热反应,则△H<0,故A错误;
B、温度越高速率越快,c点的温度高于a点温度,所以c点的速率大于a点的速率,故B错误;
C、b点是平衡状态,b点时0~10s I-的平均反应速率为v(I-)=$\frac{1-0.4}{10}$=0.060.04mol•L-1•s-1,故C错误;
D、b点后的曲线上的点都是对应温度下的平衡状态,所以d点在对应的温度下处于平衡状态,故D正确;
故选D.
点评 本题考查化学平衡移动图象问题,题目难度中等,注意根据图象曲线变化分析化学方程式的特征以及温度、浓度、压强对平衡移动的影响,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
7.下列物质性质与应用对应关系正确的是( )
| A. | 氯化镁属于电解质,工业上可用电解其溶液的方法制镁 | |
| B. | 钠钾合金的硬度小,可用作快中子反应堆的热交换剂 | |
| C. | Fe2O3是红棕色固体,可以制成红色的油漆、涂料 | |
| D. | 溴单质在CCl4中的溶解度大,可用CCl4萃取Br- |
8.实验室制取氯气并回收氯化锰,能达到该实验目的装置是( )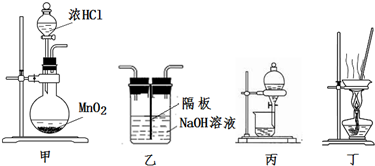

| A. | 用装置甲制取氯气 | |
| B. | 用装置丙分离二氧化锰和氯化锰溶液 | |
| C. | 用装置乙吸收制取氯气的尾气 | |
| D. | 用装置丁蒸干氯化锰溶液制 MnCl2•4H2O |
12.将2mol A和1mol B充入到绝热恒容密闭容器中,发生反应2A(g)+B(g)═3C(g)+D(s),达到平衡时测得容器内压强增大.若该反应在恒温恒容的密闭容器中进行,下列有关说法正确的是( )
| A. | 平衡前,随着反应的进行,容器内压强始终不变 | |
| B. | 平衡时,分离出少量D,A的转化率提高 | |
| C. | 平衡时,升高温度,容器内混合气体的密度减小 | |
| D. | 平衡时,充入C,该反应平衡常数减小 |
2.(NH4)2PtCl6晶体受热分解,生成氮气、氯化氢、氯化铵和金属铂.在此分解反应中,还原产物与氧化产物的物质的量之比是( )
| A. | 2:3 | B. | 1:3 | C. | 4:3 | D. | 3:2 |
6.设nA为阿伏加德罗常数的数值.下列说法正确的是( )
| A. | 常温常压下,1mol21H2含有nA个质子 | |
| B. | 1molCu与足量FeCl3溶液充分反应转移了2nA个电子 | |
| C. | 含49gH2SO4的硫酸溶液中含有nA个氢原子 | |
| D. | 标准状况下,22.4L甲醇含有nA个分子 |
7.下列关于各图的叙述正确的是( )
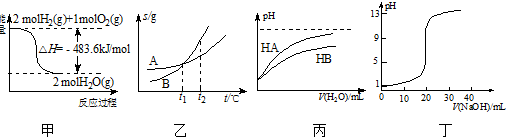

| A. | 甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ•mol-1 | |
| B. | 乙表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数ω(B)>ω( A) | |
| C. | 丙表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度NaB溶液的pH | |
| D. | 丁表示0.1000 mol•L-1 NaOH溶液滴定20.00 mL 0.1000 mol•L-1醋酸溶液得到的滴定曲线 |
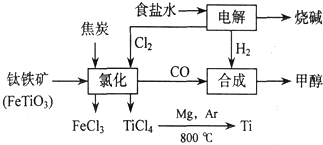
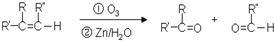
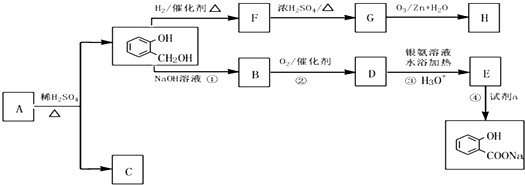
 到F反应是否进行完全,可用FeCl3溶液检验
到F反应是否进行完全,可用FeCl3溶液检验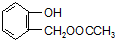 ,由F到G的反应类型为消去反应.
,由F到G的反应类型为消去反应.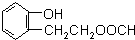 和
和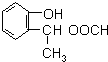 (不考虑立体异构).
(不考虑立体异构). .
.