题目内容
16.(10分,每空2分)、已知下列热化学方程式:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol,H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol,C(s)+$\frac{1}{2}$O2(g)=CO (g)△H=-110.5KJ/moL,C(s)+O2(g)=CO2(g)△H=-393.5KJ/moL.回答下列各问题:(1)H2的燃烧热为285.8kJ/moL,C的燃烧热为393.5kJ/moL.
(2)燃烧10gH2生成液态水,放出的热量为1429kJ.
(3)盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可通过间接的方法测定,则由已知条件得CO的燃烧热为283kJ/moL,其燃烧热的热化学方程式为CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283KJ/moL.
分析 (1)燃烧热是在101KP时,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,即C要转化为二氧化碳,H要转化为液态水;
(2)10g氢气的物质的量为5mol,根据热化学方程式H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol来分析;
(3)已知C(s)+$\frac{1}{2}$O2(g)=CO (g)△H=-110.5KJ/moL ③,C(s)+O2(g)=CO2(g)△H=-393.5KJ/moL ④,将④-③可得:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283KJ/moL,根据燃烧热的概念来分析.
解答 解:(1)燃烧热是在101KP时,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,即C要转化为二氧化碳,H要转化为液态水.
根据热化学方程式H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol可知:氢气的燃烧热为285.8kJ/moL;
根据热化学方程式C(s)+O2(g)=CO2(g)△H=-393.5KJ/moL可知,碳的燃烧热为393.5kJ/moL,
故答案为:285.8kJ/moL;393.5kJ/moL;
(2)10g氢气的物质的量为5mol,根据热化学方程式H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol可知,1mol氢气燃烧生成液态水时放热285.8KJ,则5mol氢气燃烧放出285.8KJ×5=1429kJ,故答案为:1429kJ;
(3)已知C(s)+$\frac{1}{2}$O2(g)=CO (g)△H=-110.5KJ/moL ③,C(s)+O2(g)=CO2(g)△H=-393.5KJ/moL ④,将④-③可得:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283KJ/moL,故CO的燃烧热为283kJ/moL,燃烧热的热化学方程式中可燃物必须为1mol,故为CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283KJ/moL,
故答案为:283kJ/moL;CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283KJ/moL.
点评 本题考了燃烧热的计算和燃烧热的热化学方程式的书写,并考查了应用查盖斯定律进行反应热的计算,燃烧热的热化学方程式的书写,容易出错,应注意把握.

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案(1)请写出工业上由NH3制取NO的化学方程式4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$ 4NO+6H2O.
(2)一定条件下,铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),已知该反应的平衡常数K与温度T的关系如图所示.
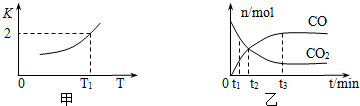
①该反应的逆反应是放热(填“吸热”或“放热”)反应.
②T℃、P pa压强下,在体积为VL的容器中进行反应,下列能说明反应达到平衡状态的是A.
A、混合气体的平均相对分子质量不再变化;
B、容器内压强不再变化;
C、v正(CO2)=v逆(FeO)
③T1温度下,向体积为V L的密闭容器中加入足量铁粉并充入一定量的CO2,反应过程中CO和CO2物质的量与时间的关系如图乙所示.则CO2的平衡转化率为$\frac{2}{3}$,平衡时混合气体的密度与起始时气体的密度之比为$\frac{25}{33}$.
(3)在恒温条件下,起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2+3H2?2NH3,有关数据及平衡状态特定见表.
| 容器 | 起始投入 | 达平衡时 | |||
| 甲 | 2mol N2 | 3mol H2 | 0mol NH3 | 1.5mol NH3 | 同种物质的体积分数相同 |
| 乙 | a mol N2 | b mol H2 | 0mol NH3 | 1.2mol NH3 | |
(4)一定条件下,2.24L(折算为标准状况)N2O和CO的混合气体在点燃条件恰好完全反应,放出bkJ热量.生成的3种产物均为大气组成气体,并测得反应后气体的密度是反应前气体密度的 $\frac{6}{7}$倍.请写出该反应的热化学方程式4N2O(g)+2CO(g)═4N2(g)+2CO2(g)+O2(g)△H=-60bkJ•mol-1.
| A. | 碳的燃烧 | B. | 葡萄糖在人体内氧化分解 | ||
| C. | Ba(OH)2•8H2O与NH4Cl反应 | D. | 锌粒与稀H2SO4反应制取H2 |
| A. | 分离苯和水的混合物,可用分液法 | |
| B. | 从Na2CO3溶液中得到Na2C03,可用过滤法 | |
| C. | 分离酒精和CCl4的混合物,可用分液法 | |
| D. | 分离NaCl和AgCl的混合物,可用萃取法 |
已知:
 $→_{85℃}^{浓H_{2}SO_{4}}$
$→_{85℃}^{浓H_{2}SO_{4}}$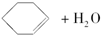

| 密度(g•cm-3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是防止液体暴沸,②导管B除了导气外还具有的作用是冷凝.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,分液后用c(填入编号)洗涤.
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按如图2装置蒸馏,冷却水从g(填g或f)口进入.蒸馏时要加入生石灰,目的是除去环己烯中少量的水.
③收集产品时,控制的温度应在83℃左右,实验制得的环己烯精品质量低于理论产量,可能的原因是c.
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出.
 .
.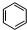 +Cl2$\stackrel{FeCl_{3}}{→}$
+Cl2$\stackrel{FeCl_{3}}{→}$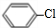 +HCl.
+HCl.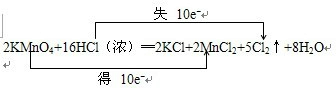 .
.