题目内容
3.在恒温,体积为2L的密闭容器中通入1molN2和xmolH2,发生如下反应:N2+3H2?2NH3.20min后达到平衡,测得反应放出的热量为18.4kJ,混合气体的物质的量为3.6mol,容器内的压强变为原来的90%.请回答下问题:(1)x=3;
(2)20min内用NH3表示的平均反应速率为0.01mol/(L.min),;
(3)该反应的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol.
(4)提述条件下,下列叙述中能表示该反应达到平衡状态的是②⑤⑥(填序号).
①单位时间内生成2nmolNH3的同时消耗nmolN2
②单位时间内断裂1molN≡N键的同时生成3molH-H键
③用N2、H2、NH3表示的反应速率数值之比为1:3:2
④混合气体的密度不再改变
⑤混合气体的压强不再改变
⑥2v正(H2)=3v逆(NH3)
分析 (1)恒温恒容下,压强之比等于物质的量之比,据此计算反应前氮气、氢气总物质的量,进而计算氢气物质的量;
(2)设消耗的氮气为n mol,表示出平衡时各组分物质的量,再根据平衡时混合气体总物质的量列方程计算n,再根据v=$\frac{△c}{△t}$计算v(NH3);
(3)计算1mol氮气反应放出的热量,注明物质的聚集状态与反应热书写热化学方程式;
(4)可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些物理量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡.
解答 解:(1)在恒温,体积为2L的密闭容器中通入1molN2和xmolH2,20min后达到平衡,混合气体的物质的量为3.6mol,容器内的压强变为原来的90%,则反应前混合气体总物质的量为$\frac{3.6mol}{90%}$=4mol,故氢气为4mol-1mol=3mol,即x=3,故答案为:3;
(2)设消耗的氮气为n mol,则:
N2(g)+3H2(g)?2NH3(g)
起始量(mol):1 3 0
变化量(mol):n 3n 2n
平衡量(mol):1-n 3-3n 2n
所以:1-n+3-3n+2n=3.6,解得n=0.2,v(NH3)=$\frac{\frac{0.4mol}{2L}}{20min}$=0.01mol/(L.min),
故答案为:0.01mol/(L.min);
(3)1mol氮气反应放出的热量为18.4kJ×$\frac{1mol}{0.2mol}$=92kJ,热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol;
(4)①单位时间内生成2nmolNH3的同时消耗nmolN2,均表示正反应速率,反应始终按该比例关系进行,故错误;
②单位时间内断裂1molN≡N键的同时生成3molH-H键,而生成3molH-H键同时生成1molN≡N键,氮气的消耗速率与生成速率相等,说明到达平衡,故正确;
③用N2、H2、NH3表示的反应速率数值之比为1:3:2,反应开始即按该比例关系进行,故错误;
④混合气体总质量不变,容器容积不变,混合气体的密度不始终不变,故错误;
⑤随反应进行混合气体总物质的量减小,恒温恒容下混合气体的压强随反应进行进行,而压强不再改变说到达平衡,故正确
⑥2v正(H2)=3v逆(NH3),不同物质表示的正逆速率之比等于化学计量数之比,反应到达平衡,故正确,
故选:②⑤⑥.
点评 本题考查化学平衡计算、平衡状态判断、热化学方程式书写等,难度中等,注意平衡状态判断中判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡.

已知:
 $→_{85℃}^{浓H_{2}SO_{4}}$
$→_{85℃}^{浓H_{2}SO_{4}}$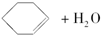

| 密度(g•cm-3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是防止液体暴沸,②导管B除了导气外还具有的作用是冷凝.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,分液后用c(填入编号)洗涤.
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按如图2装置蒸馏,冷却水从g(填g或f)口进入.蒸馏时要加入生石灰,目的是除去环己烯中少量的水.
③收集产品时,控制的温度应在83℃左右,实验制得的环己烯精品质量低于理论产量,可能的原因是c.
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出.
| t/s | 0 | 5 | 15 | 25 | 35 |
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
| A. | 反应在前5s的平均速率v(A)=0.17mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(A)=0.41mol•L-1,则反应的△H>0 | |
| C. | 相同温度下,起始时向容器中充入2.0mol C,达到平衡时,C的转化率大于80% | |
| D. | 相同温度下,起始时向容器中充入0.20mol A、0.20mol B和1.0mol C,反应达到平衡前v(正)<v(逆) |
T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
| 时间/s | 0 | 500 | 100 0 | 150 0 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2 | |
| B. | 500s内N2O5分解速率为2.96×10-3mol•L-1•s-1 | |
| C. | 达平衡后其他条件不变,将容器的体积压缩到原来的 $\frac{1}{2}$,则c(N2O5)>5.00mol•L-1 | |
| D. | T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50% |
CO(g)+2H2(g)═CH3OH(g)△H
(1)化学平衡常数(K)的表达式为$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$.
(2)下表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.04 | 0.25 | 0.012 |
(3)某温度下,将6mol CO和4.4mol H2充入2L的密闭容器中,10min该反应达到平衡,测得c(CO)=2.4mol•L-1,则用H2表示的10min内该反应的反应速率为0.12mol•L-1•min-1,此时的温度为300℃(从上表中选择),H2转化率=54.5%.
(4)判断该可逆反应达到化学平衡状态的标志是③④⑥(填序号).
①单位时间内,消耗2mol H2,同时生成1molCH3OH
②混合气体的密度不再改变
③混合气体的平均相对分子质量不再改变
④CO、H2、CH3OH的浓度均不再变化
⑤CO、H2、CH3OH的分子数目比为1:2:1
⑥混合气体的总压强不再变化.
| A. | 升高温度只能加快吸热反应速率 | |
| B. | 对于任何反应,增大压强都可加快反应速率 | |
| C. | 使用正催化剂只加快正反应速率 | |
| D. | 催化剂可以改变反应速率 |
| A. | Cu2+、SO42-、K+、Na+ | B. | Na+、Cl-、HSO3-、K+ | ||
| C. | MnSO4-、CO32-、Na+、K+ | D. | Fe3+、SO42-、S2-、Na+ |
