题目内容
13.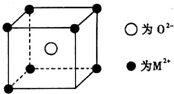 已知MO与CsCl的结构相似(如图2所示),MO晶体的密度为p g•cm-3,NA为阿伏加德罗常数,相邻的两个M2+的核间距为acm.写出Cs基态原子的价电子排布式6s1,MO的相对分子质量可以表示为ρa3 NA.
已知MO与CsCl的结构相似(如图2所示),MO晶体的密度为p g•cm-3,NA为阿伏加德罗常数,相邻的两个M2+的核间距为acm.写出Cs基态原子的价电子排布式6s1,MO的相对分子质量可以表示为ρa3 NA.
分析 Cs为第六周期第ⅠA族元素;利用均摊法确定该立方体中含有的离子,根据ρV=$\frac{M}{N{\;}_{A}}$计算相对分子质量.
解答 解:Cs为第六周期第ⅠA族元素,所以基态原子的价电子排布式6s1;
该立方体中含1个氧离子,M2+个数=8×$\frac{1}{8}$=1,根据ρV=$\frac{M}{N{\;}_{A}}$知,M=ρVNA=ρa3NA,摩尔质量在数值上等于其相对分子质量,所以其相对分子质量是ρa3 NA,
故答案为:6s1;ρa3 NA.
点评 本题考查了相对分子质量的计算,明确该立体中含有的阴阳离子个数是解本题的关键,根据摩尔质量与密度、体积和NA之间的关系来分析解答即可,难度不大

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
3.某强酸性溶液X中可能含有Na+、K+、NH4+、Fe2+、Fe3+、A13+、CO32-、SO32-、SO42-、C1-中的若干种,某同学为了确认其成分,取溶液进行连续实验,实验过程及产物如下:下列结论正确的是( )
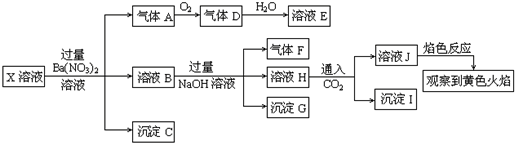

| A. | 溶液J焰色反应显黄色,则说明原溶液中存在Na+ | |
| B. | 沉淀G中加入盐酸溶解,滴加一滴KSCN溶液显红色,可以确定原溶液中有Fe3+ | |
| C. | X中不能确定的离子是 A13+、Fe3+、Na+、K+和C1- | |
| D. | 沉淀I一定是Al(OH )3 |
4.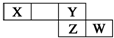 短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中X的最高正价与最低负价绝对值之差等于2.下列判断不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中X的最高正价与最低负价绝对值之差等于2.下列判断不正确的是( )
 短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中X的最高正价与最低负价绝对值之差等于2.下列判断不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中X的最高正价与最低负价绝对值之差等于2.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:Y>Z | |
| B. | Z的最高价氧化物对应水化物是强酸 | |
| C. | X元素的最简单氢化物与Y元素形成的化合物溶于水会促进水的电离. | |
| D. | 已知HY沸点远高于HZ,因为H-Y键的键能高于H-Z键. |
1.不久前,某海军航空站安装了一台250kW的MCFC型燃料电池.该电池可同时供应电和水蒸气,其工作温度为600~700℃,所用燃料为H2,电解质为熔融的K2CO3.已知该电池的总反应为2H2+O2═2H2O,负极反应为H2+CO32--2e-═H2O+CO2,则下列推断正确的是( )
| A. | 正极反应为4OH-═O2+2H2O+4e- | |
| B. | 放电时CO32-向负极移动 | |
| C. | 电池供应1 mol水蒸气,转移电子4 mol | |
| D. | 氢氧燃料电池的H2和O2都贮存于电池中 |
8.下列关于各实验装置的叙述中,正确的是( )
| A. | 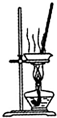 装置可用于蒸干氯化铝溶液制A1C13 | |
| B. | 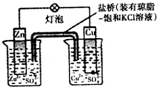 装置盐桥中的K+自右向左移动 | |
| C. | 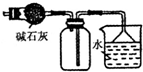 装置可用于收集NH3或HCl气体,并防止倒吸 | |
| D. | 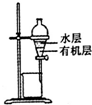 装置可用于分离CCl4萃取碘水后已分层的有机层和水层 |
18.两种物质间反应生成相同物质的量的气体时,消耗酸的物质的量最少的是( )
| A. | 碳与浓硝酸 | B. | 铜与稀硝酸 | ||
| C. | 二氧化锰与浓盐酸 | D. | 铝与稀盐酸 |
2.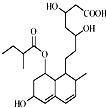 一种调节血脂的药物普伐他汀,其结构简式如图所示.下列有关普伐他汀说法正确的是( )
一种调节血脂的药物普伐他汀,其结构简式如图所示.下列有关普伐他汀说法正确的是( )
 一种调节血脂的药物普伐他汀,其结构简式如图所示.下列有关普伐他汀说法正确的是( )
一种调节血脂的药物普伐他汀,其结构简式如图所示.下列有关普伐他汀说法正确的是( )| A. | 不能使酸性KMnO4溶液褪色,但能与FeCl3溶液发生显色反应 | |
| B. | 含有4种含氧官能团 | |
| C. | 能发生加成、取代、消去反应 | |
| D. | 1mol该物质最多可与5molNaOH反应 |
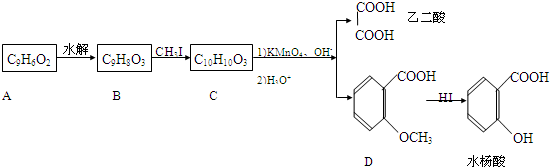
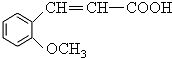
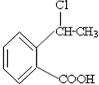 合成
合成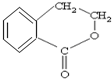 的反应流程图,请在方框内写出A与
的反应流程图,请在方框内写出A与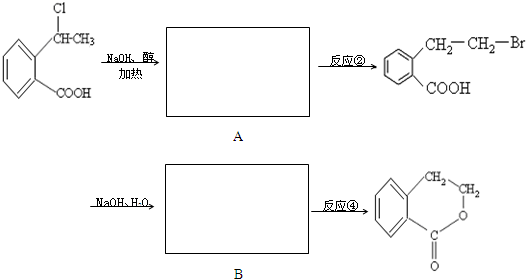
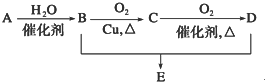 有机物A的分子式为C2H4,可能发生以下系列转化:
有机物A的分子式为C2H4,可能发生以下系列转化: