题目内容
18.硼元素在自然界主要以硼酸.硼酸盐和硼硅酸盐存在.请回答下列问题:(1)硼元素是ⅢA族的第一个元素,原子结构示意图为
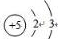 ,天然硼元素有两种稳定同位素10B、11B,其相对原子质量分别为10和11,它们的相对丰度分别为20%和80%,硼元素的平均相对质量为10.8.
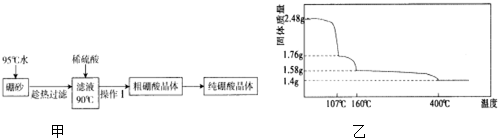
,天然硼元素有两种稳定同位素10B、11B,其相对原子质量分别为10和11,它们的相对丰度分别为20%和80%,硼元素的平均相对质量为10.8.(2)硼酸(H3BO3)是一元弱酸,工业上用硼砂(Na2B4O7•10H2O)制备硼酸晶体的流程如图甲:
不同温度下硼酸的溶解度见下表:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 |
| 溶解度/g | 2.7 | 5.0 | 8.7 | 14.8 | 23.8 |
②上述流程中获得粗硼酸晶体的操作Ⅰ为降温结晶(冷却热饱和溶液)、过滤,进一步将粗硼酸晶体提纯的方法是重结晶.
③25℃时0.1mol/L硼酸溶液的PH约为5.1,则其电离常数K约为10-9.2.
(3)硼酸在加热过程中发生分解的失重曲线如图乙所示.
①硼酸从开始加热到107℃时,发生反应的化学方程式为H3BO3═HBO2+H2O.
②硼酸加热到160℃得到的固体的化学式为H2B4O7.(B元素的相对原子质量按11计算)
(4)NaBH4由于H元素显-1价,具有强还原性,是有机化学上的万能还原剂.在碱性条件下电解NaBO2溶液可以制得NaBH4,其反应方程式为NaBO2+2H2O=2O2↑+NaBH4,则阴极反应式为BO2-+6H2O+8e-=BH4-+8OH-.
分析 (1)硼的原子序数为5,最外层含有3个电子,据此画出其原子结构示意图;硼元素的平均相对质量=各元素的相对原子质量与相对丰度的乘积之和;
(2)①Na2B4O7•10H2O与稀硫酸反应生成H3BO3和硫酸钠,据此写出反应的离子方程式;
②根据硼酸的溶解度与温度的关系可知,降低温度可以降低硼酸的溶解度,据此判断操作Ⅰ;若进一步提纯硼酸,可进行重结晶;
③25℃时0.1mol/L硼酸溶液的pH约为5.1,则氢离子浓度为:c(H+)=10-5.1mol/L,c(H2BO3-)≈c(H+)=10-5.1mol/L,由于硼酸的电离程度较小,则0.1mol/L硼酸溶液中未电离的硼酸浓度约为0.1mol/L,结合电离平衡常数的表达式计算出硼酸的电离平衡常数;
(3)①加热硼酸的过程中,固体减少部分为水的质量,根据质量变化及硼酸的物质的量计算出1分子硼酸分解生成水的物质的量,然后写出反应方程式;
②固体减少的质量为水的质量,根据质量守恒定律判断反应后固体的化学式;
(4)电解池中阳极发生氧化反应、阴极发生还原反应,结合总反应方程式及化合价变化写出阴极电解反应式.
解答 解:(1)硼的核电荷数=核外电子总数=5,其原子结构示意图为: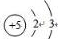 ;天然硼元素有两种稳定同位素10B、11B,其相对原子质量分别为10和11,它们的相对丰度分别为20%和80%,则硼元素的平均相对质量为:10×20%+11×80%=10.8,
;天然硼元素有两种稳定同位素10B、11B,其相对原子质量分别为10和11,它们的相对丰度分别为20%和80%,则硼元素的平均相对质量为:10×20%+11×80%=10.8,
故答案为: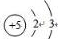 ; 10.8;
; 10.8;
(2)①硼砂溶液中溶质为Na2B4O7•10H2O,与稀硫酸反应生成H3BO3和硫酸钠,反应的离子方程式为:5H2O+B4O72-+2H+=4H3BO3,
故答案为:5H2O+B4O72-+2H+=4H3BO3;
②根据表中硼酸的溶解度可知,硼酸受温度的影响较大,可以通过降低温度的方法分离出硼酸,则上述流程中获得粗硼酸晶体的操作Ⅰ为降温结晶(冷却热饱和溶液)、过滤,若进一步将粗硼酸晶体提纯,可以通过重结晶的方法完成,
故答案为:降温结晶(冷却热饱和溶液);重结晶;
③25℃时0.1mol/L硼酸溶液的pH约为5.1,则该溶液中氢离子浓度为:c(H+)=10-5.1mol/L,c(H2BO3-)≈c(H+)=10-5.1mol/L,由于硼酸的电离程度较小,则0.1mol/L硼酸溶液中未电离的硼酸浓度约为0.1mol/L,所以硼酸的电离平衡常数为:K=$\frac{1{0}^{-5.1}×1{0}^{-5.1}}{0.1}$=10-9.2,
故答案为:10-9.2;
(3)①2.48g硼酸的物质的量为:$\frac{2.48g}{62g/mol}$=0.04mol,107℃时减少的固体质量为:2.48g-1.76g=0.72g,减少部分应该为水的质量,减少的水的物质的量为:$\frac{0.72g}{18g/mol}$=0.04mol,则1分子硼酸失去1分子水,所以该过程中反应的方程式为:H3BO3═HBO2+H2O,
故答案为:H3BO3═HBO2+H2O;
②剩余固体从107℃加热到160℃时,减少水的质量为:1.76g-1.58g=0.18g,其物质的量为:$\frac{0.18g}{18g/mol}$=0.01mol,0.04mol HBO2中含有0.04molH、0.04molB和0.08molO,失去0.01mol水后得到的固体中含有:0.02molH、0.04molB和0.07molO,则H、B、O原子数之比为:2:4:7,则反应后固体的化学式为:H2B4O7,
故答案为:H2B4O7;
(4)总反应为NaBO2+2H2O=2O2↑+NaBH4,电解过程中阳极发生氧化反应,阴极发生还原反应,则阴极H2O得到电子与BO2-结合生成BH4-和氢氧根离子,阴极的电极反应式为:BO2-+6H2O+8e-=BH4-+8OH-,
故答案为:BO2-+6H2O+8e-=BH4-+8OH-.
点评 本题考查了制备实验方案的设计,题目难度较大,涉及原子结构与元素周期表的应用、物质制备方案的设计、电解原理及其应用、电离平衡常数的计算等知识,试题知识点较多、综合性较强,充分考查了学生灵活应用基础知识的能力,注意掌握物质制备方案的设计与评价方法,(3)为难点,明确固体减少部分为水的质量为解答关键.

 53随堂测系列答案
53随堂测系列答案| A. | 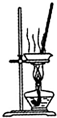 装置可用于蒸干氯化铝溶液制A1C13 | |
| B. | 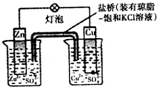 装置盐桥中的K+自右向左移动 | |
| C. | 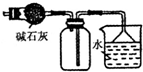 装置可用于收集NH3或HCl气体,并防止倒吸 | |
| D. | 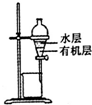 装置可用于分离CCl4萃取碘水后已分层的有机层和水层 |
 利用图所示装置进行以下实验,能得到相应实验结论的是( )
利用图所示装置进行以下实验,能得到相应实验结论的是( )| 选项 | ① | ② | ③ | 实验结论 |
| A | 稀硫酸 | 石灰石 | 澄清石灰水 | 制二氧化碳并吸收尾气 |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
| C | 稀盐酸 | Na2SO3 | H2S溶液 | SO2具有还原性 |
| D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 61 | B. | 27 | C. | 88 | D. | 34 |
| A. | 2015年3月5日,李克强总理在政府工作报告中说:“生态环保贵在行动、成在坚持,要求全年能耗强度下降3.1%以上”,从源头上消除污染,这符合“绿色化学”的理念 | |
| B. | 农业废弃物、水生植物、油料植物、城市与工业有机废弃物、动物粪便等均蕴藏着丰富的生物质能 | |
| C. | 硅藻泥材料具有很好的吸音降噪、净化空气、防霉防潮等性能,已成为当下时兴的环保装修材料,硅藻泥主要原材料为硅藻上,成分是SiO2,拥有多空的结构,具有强吸附性 | |
| D. | 把粉末状的氢化钛泡沫剂添加到熔融的金属铝中,冷却后可得到某种金属泡沫,利用该金属泡沫具有强度低、质量轻等特性可用于建造海上漂浮城市. |
(1)上述实验中发生反应的离子方程式有Zn+Cu2+=Zn2++Cu、Zn+2H+=Zn2++H2↑;
(2)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 | A | B | C | D | E | F | |
| 混 合 溶 液 | 4mol/LH2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 | |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 | |
| 时间(min) | 15 | 10 | 5 | 3 | 6 | 9 | |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降,请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在Zn表面,降低了Zn与溶液接触的表面,使得氢气的生成速率反而下降;
(3)改用锌粉与稀硫酸反应,加入少量硫酸铜溶液后充分振荡,一段时间剩余少量固体.该同学对固体成分提出下列假设:
假设1:全部为铜;
假设2:既有Zn又有Cu.
(4)请你设计实验验证上述假设1,完成下表内容.
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
| , |
| A. | 钢制品应接电源的正极 | |
| B. | 电镀时铝作阳极,阳极反应式为Al-3e-+7AlCl4-=4Al2Cl7- | |
| C. | 电解液中H+移向阴极,OH-移向阳极 | |
| D. | 每生成1mol铝,电解液中转移3mol电子 |
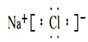 .
. 有机物A的分子式为C2H4,可能发生以下系列转化:
有机物A的分子式为C2H4,可能发生以下系列转化: