题目内容
20.铁单质及其化合物在生活、生产中应用广泛.请回答:(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应式为O2+2H2O+4e-=4OH-.
(2)由于氧化性Fe3+>Cu2+,氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是2Fe3++Cu=2Fe2++Cu2+.
(3)若将(2)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式.
正极反应Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+)
负极反应Cu=2Cu2++2e-(或Cu-2e-=Cu2+).
(4)下表中,对陈述I、Ⅱ的正确性及其有无因果关系的判断都正确的是B(填字母).
| 陈述I | 陈述Ⅱ | 判断 | |
| A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | I对;Ⅱ对;有 |
| B | 常温下铁与稀硫酸反应生成氢气 | 高温下氢气能还原氧化铁得到铁 | I对;Ⅱ对;无 |
| C | 铁属于过渡元素 | 铁的某些化合物可用作催化剂 | I错;Ⅱ对;无 |
| D | 在空气中铁表面形成致密氧化膜 | 铁不能与氧气反应 | I对;Ⅱ对;有 |
分析 (1)钢铁发生吸氧腐蚀的正极反应得到电子,发生还原反应;
(2)三价铁离子具有强的氧化性,能够氧化铜单质;
(3)依据离子方程式:2Fe3++Cu=2Fe2++Cu2+,铜发生氧化反应,做负极,三价铁离子发生还原反应,可以用C作正极,电解液为氯化铁,原电池工作时,负极上铜被氧化,正极上Fe3+被还原;
(4)A.地壳中含量最高的是铝,人类使用最早的金属是铜;
B.铁与稀硫酸反应生成氢气,氢气在高温下能够还原铁;
C.铁位于ⅤⅢ族,属于过度元素;
D.铁能与氧气反应.
解答 解:(1)钢铁发生吸氧腐蚀的正极反应得到电子发生还原反应,正极反应式为O2+4e-+2H2O═4OH-,故答案为:O2+4e-+2H2O═4OH-;
(2)三价铁离子与铜发生氧化还原反应生成二价铁离子和铜离子,离子方程式:2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
(3)依据方程式2Fe3++Cu=2Fe2++Cu2+可知该电池反应中三价铁离子得电子发生还原反应,所以正极上的电极反应式为Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+),铜失电子发生氧化反应,所以负极上的电极反应式为Cu-2e-=Cu2+;
用铜做负极,碳做正极,三氯化铁做电解质溶液,形成原电池,如图: ;
;
故答案为:Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+);Cu=2Cu2++2e-(或Cu-2e-=Cu2+); ;
;
(4)A.地壳中含量最高的是铝,不是铁,人类使用最早的金属是铜,I不对;Ⅱ不对,故A错误;
B.铁与稀硫酸反应生成氢气,氢气在高温下能够与氧化铁反应生成铁,二者都正确,但是无联系,故B正确;
C.铁位于ⅤⅢ族,属于过度元素,陈述Ⅰ错误,故C错误;
D.铁能与氧气反应,生成致密氧化膜,阻碍反应进行,陈述Ⅱ错误,故D错误;
故选:B.
点评 本题考查了铁的化学性质和原电池设计及电极反应式书写,明确原电池工作原理是解题关键,题目难度不大.

| A. | 对稀土元素及化合物的研究是获得优良催化剂的一种重要途径 | |
| B. | 油脂是人体中热值最高的营养物质,在工业上可用于制肥皂和油漆 | |
| C. | 离子键、共价键和氢键等化学键都可能对物质的熔沸点产生影响 | |
| D. | 高分子膜在分离提纯、物质制备以及能量转化等领域都有广泛应用 |
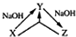 化学之“化”,体现在物质之间的相互转化,用X表示下列物质,其中在溶液中不可能实现如图转化关系的是( )
化学之“化”,体现在物质之间的相互转化,用X表示下列物质,其中在溶液中不可能实现如图转化关系的是( )| A. | AlCl3 | B. | CO2 | C. | SiO2 | D. | H2S |
| A. | 碱性:Al(OH)3、Mg(OH)2、NaOH | B. | 还原性:HCl、HBr、HI | ||
| C. | 酸性:HClO4、H2SO4、H3PO4 | D. | 稳定性:HI、HBr、HCl |
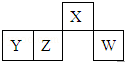 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | X的氢化物与氯化氢反应的产物溶于水形成的溶液呈酸性 | |
| C. | 最简单气态氢化物的热稳定性:Z>W | |
| D. | 含Y元素的盐溶液一定显酸性 |
| A. | C2H4 | B. | CaCl2 | C. | Na2O2 | D. | NH4NO3 |

| A. | 原子序数是15 | B. | 它是非金属元素 | ||
| C. | 磷原子最外层有5个电子 | D. | 磷元素在地壳中的含量为30.97% |
 现用如图装置来测定原电池工作时在某段时间内通过导线的电子的物质的量.量筒的规格为1000mL,供选择的电极材料有纯铜片和纯锌片.请回答下列问题:
现用如图装置来测定原电池工作时在某段时间内通过导线的电子的物质的量.量筒的规格为1000mL,供选择的电极材料有纯铜片和纯锌片.请回答下列问题: