题目内容
13.下列各组离子因发生氧化还原反应而不能大量共存的是( )| A. | H+、Fe2+、MnO4-、SO42- | B. | Ca2+、H+、SO42-、HCO3- | ||
| C. | Na+、Cu2+、Cl-、OH- | D. | Fe3+、K+、SCN-、Cl- |
分析 A.酸性高锰酸根离子具有强氧化性,能够氧化亚铁离子;
B.钙离子与硫酸根离子反应生成硫酸钙、氢离子与碳酸氢根离子反应,都不是氧化还原反应;
C.铜离子与氢氧根离子反应生成氢氧化铜,该反应不属于氧化还原反应;
D.铁离子与硫氰根离子反应生成络合物,不属于氧化还原反应.
解答 解:A.H+、Fe2+、MnO4-之间发生氧化还原反应,在溶液中不能大量共存,故A正确;
B.Ca2+、SO42-反应生成硫酸钙,H+、HCO3-之间反应生成二氧化碳,都不属于氧化还原反应,故B错误;
C.Cu2+、OH-之间反应生成氢氧化铜,不属于氧化还原反应,故C错误;
D.Fe3+和SCN-之间反应生成硫氰化铁,该反应不属于氧化还原反应,故D错误;
故选A.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案
相关题目
4.生产生活中处处有化学,下列有关说法错误的是( )
| A. | 铁表面镀锌可增强铁的抗腐蚀性 | |
| B. | 糖类、油脂、蛋白质等是食物中的基本营养物质 | |
| C. | 雾霾、温室效应、光化学烟雾的形成都与氮的氧化物有关 | |
| D. | 氯气和活性炭是常用的漂白剂,但同时使用会降低或失去漂白性 |
1.实验室常用强氧化剂(如KMnO4、KClO3、MnO2等)氧化浓盐酸的方法来制备氯气.某研究性学习小组欲探究用Na2O2与浓盐酸制备并检验氯气,供选用的实验试剂及装置如下(部分导管、蒸馏水略去).
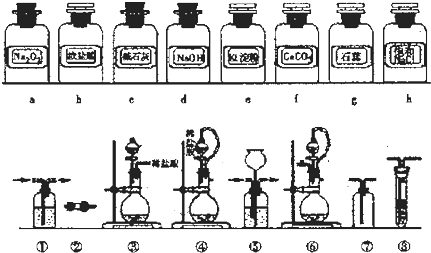
I.写出制取氯气的化学方程式或离子方程式:
①MnO2与浓盐酸制取氯气的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
②Na2 O2与浓盐酸制备氯气的化学方程式Na2O2+4HCl=2NaCl+Cl2↑+2H2O.
Ⅱ.完成用Na2O2与浓盐酸制备氯气的有关问题:
(1)下列装置组合最合理的是D(填序号,需考虑实验结束撤除装置时残留有害气体的处理).
(2)尾气经处理后仍有较多气体排出,其主要原因用化学方程式表示为2Na2O2+2H2O=4NaOH+O2↑(或4Na2O2+4HCl=4NaCl+2H2O+O2↑)
(3)某小组成员建议用双氧水代替过氧化钠进行实验更好,请你给出两条合适的理由:
①Na2O2能与水反应,会使原料的利用率降低,
②双氧水比Na2O2更经济.
(4)你是否同意将Na2O2与浓盐酸的反应作为实验室制备氯气的方法之一?否(填“是”或“否”);理由是产物不纯且难以分离.

I.写出制取氯气的化学方程式或离子方程式:
①MnO2与浓盐酸制取氯气的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
②Na2 O2与浓盐酸制备氯气的化学方程式Na2O2+4HCl=2NaCl+Cl2↑+2H2O.
Ⅱ.完成用Na2O2与浓盐酸制备氯气的有关问题:
(1)下列装置组合最合理的是D(填序号,需考虑实验结束撤除装置时残留有害气体的处理).
| 组合 | 制备装置 | 净化装置 | 检验装置/-试剂 | 尾气处理装置 |
| A | ③ | ② | ⑦/e | ⑤ |
| B | ③⑥ | ① | ⑧/g | ① |
| C | ④ | ① | ⑤/e | ② |
| D | ④⑥ | ⑤ | ⑧/g | ① |
(3)某小组成员建议用双氧水代替过氧化钠进行实验更好,请你给出两条合适的理由:
①Na2O2能与水反应,会使原料的利用率降低,
②双氧水比Na2O2更经济.
(4)你是否同意将Na2O2与浓盐酸的反应作为实验室制备氯气的方法之一?否(填“是”或“否”);理由是产物不纯且难以分离.
8.有机化合物在人类生活和生产中必不可少,下列对有机化合物的叙述不正确的是( )
| A. | 淀粉、蛋白质均属于高分子化合物,油脂不属于高分子化合物 | |
| B. | 乙醇的分子式为C2H6O,常温下是一种无色液体,密度比水小 | |
| C. | 乙酸的结构简式是CH3COOH,能和水以任意比互溶,酸性比碳酸强 | |
| D. | 乙烯是重要的化工原料,能使溴水和酸性高锰酸钾溶液褪色,具有漂白作用 |
18.下列溶液一定呈中性的是( )
| A. | pH=7的溶液 | |
| B. | c(H+)=c(OH-)的溶液 | |
| C. | 由强酸、强碱等物质的量反应得到的溶液 | |
| D. | 盐溶于水得到的溶液 |
5.下列说法错误的是( )
| A. | 红葡萄酒密封窖藏,储存一段时间,香味愈浓,原因之一是储存过程中生成了有香味的酯 | |
| B. | 用浸泡过高锰酸钾溶液的硅土吸收水果或花朵产生的乙烯,可以延迟长水果或花朵的成熟期 | |
| C. | 炒菜时,加一点酒和醋能使菜更加味香可口,原因是有酯类生成 | |
| D. | 油脂能增加食物的滋味,增进食欲,因此在饮食中没有必要控制油脂的摄入量 |
2.填写下表:
| 分子或离子 | SO3 | SO2 | ClO3- | HCN | NF3 | NO3- |
| 中心原子孤电子对数 | 0 | 1 | 1 | 0 | 1 | 0 |
| σ键电子对数 | 3 | 2 | 3 | 2 | 3 | 3 |
| 中心原子的杂化轨道类型 | Sp2 | Sp2 | Sp3 | Sp | Sp3 | Sp2 |
| VSEPR模型名称 | 平面三角形 | V形 | 四面体 | 直线形 | 四面体 | 平面三角形 |
| 分子或离子立体构型名称 | 平面三角形 | V形 | 三角锥 | 直线形 | 三角锥 | 平面三角形 |
3.锌片和铜片用导线连接后插入稀硫酸中可构成原电池,从原电池角度判断锌片作( )
| A. | 正极 | B. | 负极 | C. | 阴极 | D. | 阳极 |
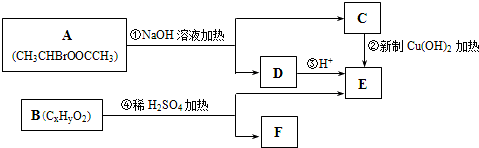
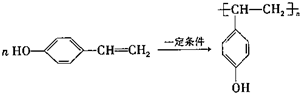 .
.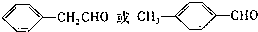 等.
等.