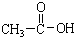题目内容
18.下列溶液一定呈中性的是( )| A. | pH=7的溶液 | |
| B. | c(H+)=c(OH-)的溶液 | |
| C. | 由强酸、强碱等物质的量反应得到的溶液 | |
| D. | 盐溶于水得到的溶液 |
分析 溶液呈酸碱性本质,取决与溶液中H+浓度与OH-浓度的相对大小,当溶液中:c(H+)>c(OH-),溶液呈酸性;c(H+)=c(OH-),溶液呈中性;c(H+)<c(OH-),溶液呈碱性;常温下,水的离子积Kw=1×10-14,所以,pH<7,溶液呈酸性;pH=7,溶液呈中性;pH>7,溶液呈碱性.Kw受温度影响,水的电离是吸热反应,温度越高Kw越大,据此进行判断.
解答 解:A、pH=7的溶液,不一定是常温下,水的离子积不一定是Kw=1×10-14,溶液中c(H+)、c(OH-)不一定相等,故A错误;
B、溶液呈酸碱性本质,取决与溶液中H+浓度与OH-浓度的相对大小,溶液中氢离子浓度大于氢氧根离子浓度,溶液一定显示中性,故B正确;
C、由强酸与强碱等物质的量反应得到的溶液,若氢离子浓度物质的量与氢氧根离子的物质的量不相等,反应后溶液不会显示中性,故C错误;
D、强酸弱碱盐在溶液中水解显酸性,强碱弱酸盐在溶液中水解显碱性,则盐溶于水得到的溶液不一定显中性,故D错误;
故选:B.
点评 本题考查了溶液酸碱性的判断,溶液的酸碱性是由溶液中H+浓度与OH-浓度的相对大小决定的,而不在于c(H+)或c(OH-)绝对值的大小,题目难度不大.

练习册系列答案
相关题目
1.短周期主族元素X、Y、Z、W原子序数依次增大.已知:X、Z同主族,X、Y、Z三种元素原子的最外层电子数之和为15,Y原子最外层电子数等于X原子最外层电子数的一半.下列叙述正确的是( )
| A. | 原子半径:X<W<Y<Z | |
| B. | X的氢化物稳定性大于Z的氢化物稳定性 | |
| C. | X在自然界中只能以化合态形式存在 | |
| D. | W的单质可使干燥的红色布条褪色 |
9.对如图所示实验装置的说明错误的是( )
| A. |  能作为SO2的干燥装置 | |
| B. |  验证铁钉的吸氧腐蚀 | |
| C. |  可用于测量Cu与浓硝酸反应生成NO2的体积 | |
| D. |  可证明酸性:H2SO4>H2CO3>H2SiO3 |
6.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 1.00molNaCl固体中含有6.02×1023个NaCl分子 | |
| B. | 46gNO2和N2O4混合气体中含有原子总数为3NA | |
| C. | 1molFe2+与足量的H2O2溶液反应,转移2NA个电子 | |
| D. | 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
13.下列各组离子因发生氧化还原反应而不能大量共存的是( )
| A. | H+、Fe2+、MnO4-、SO42- | B. | Ca2+、H+、SO42-、HCO3- | ||
| C. | Na+、Cu2+、Cl-、OH- | D. | Fe3+、K+、SCN-、Cl- |
10.下列变化属于物理变化的是( )
| A. | 石油分馏 | B. | 煤干馏 | ||
| C. | 淀粉在人体内消化 | D. | 石油裂解 |
7.下列实验做法不正确的是( )
| A. | 用无水硫酸铜检验乙醇中是否含水 | |
| B. | 用溴水检验汽油中是否含有不饱和脂肪烃 | |
| C. | 用蒸馏的方法可以分离醋酸与乙醇的混合物 | |
| D. | 检验某卤代烃中是否含溴:加入NaOH溶液,加热,冷却,再加入硝酸银溶液 |
8.锌粒与2mol/L的硫酸反应,用以下措施不能增大该化学反应速率的是( )
| A. | 用锌粉代替锌粒 | B. | 改用热的2 mol/L硫酸溶液 | ||
| C. | 改用3 mol/L硫酸溶液 | D. | 向该硫酸溶液中加入等体积的水 |
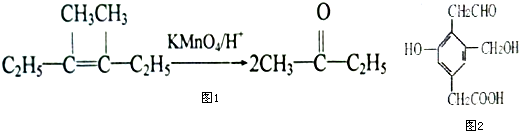
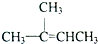 在上述条件下发生反应,得到的最终产物结构式分别是:
在上述条件下发生反应,得到的最终产物结构式分别是: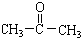 、
、