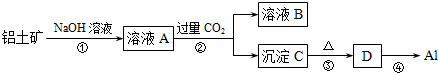
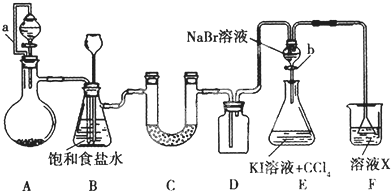
题目内容
3.锌片和铜片用导线连接后插入稀硫酸中可构成原电池,从原电池角度判断锌片作( )| A. | 正极 | B. | 负极 | C. | 阴极 | D. | 阳极 |
分析 铜、锌和稀硫酸能构成原电池,锌易失电子而作负极,铜作正极.
解答 解:将铜片与锌片用导线连接入插入稀硫酸中,符合原电池的构成条件,所以锌、铜和稀硫酸构成原电池,锌片易失电子发生氧化反应而作负极,则铜作正极,正极上氢离子得电子发生还原反应,
故选B.
点评 本题考查了原电池正负极的判断,难度不大,注意原电池中电极是正负极,而电解池中电极是阴阳极,为易错点.

练习册系列答案
相关题目
13.下列各组离子因发生氧化还原反应而不能大量共存的是( )
| A. | H+、Fe2+、MnO4-、SO42- | B. | Ca2+、H+、SO42-、HCO3- | ||
| C. | Na+、Cu2+、Cl-、OH- | D. | Fe3+、K+、SCN-、Cl- |
14.下列反应中,在原理上可以设计成原电池的是( )
| A. | 氢氧化钙固体与氯化铵固体的反应 | B. | 氨气和氯化氢化合 | ||
| C. | 甲烷与氧气的反应 | D. | 石灰石的分解反应 |
18.下列反应的离子方程式正确的是( )
| A. | 次氯酸钙溶液中通入过量的二氧化碳 Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| B. | 硫酸亚铁溶液中加入过氧化氢溶液 Fe2++2H2O2+4H+═Fe3++4H2O | |
| C. | 用氨水吸收少量二氧化硫 OH-+SO2═HSO3- | |
| D. | 硝酸铁溶液加入过量氨水 3NH3•H2O+Fe3+═Fe(OH)3↓+3 NH4+ |
8.锌粒与2mol/L的硫酸反应,用以下措施不能增大该化学反应速率的是( )
| A. | 用锌粉代替锌粒 | B. | 改用热的2 mol/L硫酸溶液 | ||
| C. | 改用3 mol/L硫酸溶液 | D. | 向该硫酸溶液中加入等体积的水 |
15.2012年4月,中央电视台曝光了不法商贩将重金属铬(Cr)超标的工业明胶加工成药用胶囊的“毒胶囊”事件.已知铬的原子序数为24,下列叙述正确的是( )
| A. | 铬位于元素周期表的第四周期第Ⅷ族 | |
| B. | 警察通过装有橙色的酸性重铬酸钾的装置检查司机是否酒后驾车 | |
| C. | 已知铬元素的一种同位素的质量数为53,则该同位素有53个中子 | |
| D. | 中子数为29的铬原子符号表示为${\;}_{24}^{29}$Cr |
13.下列化学实验事实及其解释或结论都正确的是( )
| A. | 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| B. | 向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡后再加入0.5 mL有机物X,加热后未出现砖红色沉淀,说明X中不含有醛基 | |
| C. | 向CuSO4溶液中加入KI溶液,有白色沉淀生成,再加入四氯化碳振荡,四氯化碳层呈紫色,说明白色沉淀可能为CuI | |
| D. | 向浓度均为0.1 mol•L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,首先生成蓝色沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2] |