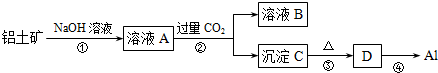
题目内容
1.实验室常用强氧化剂(如KMnO4、KClO3、MnO2等)氧化浓盐酸的方法来制备氯气.某研究性学习小组欲探究用Na2O2与浓盐酸制备并检验氯气,供选用的实验试剂及装置如下(部分导管、蒸馏水略去).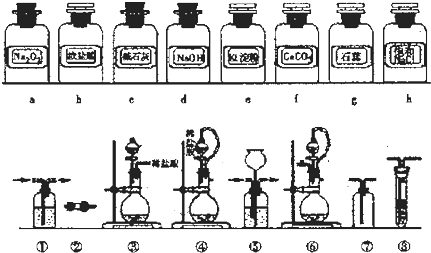
I.写出制取氯气的化学方程式或离子方程式:
①MnO2与浓盐酸制取氯气的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
②Na2 O2与浓盐酸制备氯气的化学方程式Na2O2+4HCl=2NaCl+Cl2↑+2H2O.
Ⅱ.完成用Na2O2与浓盐酸制备氯气的有关问题:
(1)下列装置组合最合理的是D(填序号,需考虑实验结束撤除装置时残留有害气体的处理).
| 组合 | 制备装置 | 净化装置 | 检验装置/-试剂 | 尾气处理装置 |
| A | ③ | ② | ⑦/e | ⑤ |
| B | ③⑥ | ① | ⑧/g | ① |
| C | ④ | ① | ⑤/e | ② |
| D | ④⑥ | ⑤ | ⑧/g | ① |
(3)某小组成员建议用双氧水代替过氧化钠进行实验更好,请你给出两条合适的理由:
①Na2O2能与水反应,会使原料的利用率降低,
②双氧水比Na2O2更经济.
(4)你是否同意将Na2O2与浓盐酸的反应作为实验室制备氯气的方法之一?否(填“是”或“否”);理由是产物不纯且难以分离.
分析 I.①在加热条件下,二氧化锰与浓盐酸反应生成氯化锰、氯气和水;
②过氧化钠具有强氧化性,能把浓盐酸氧化为氯气,同时自身被还原成水,再结合原子守恒写出反应方程式;
II.(1)根据反应物的性质选取反应装置,根据气体的成分及性质选取洗气装置,根据实验目的选取检验装置,根据氯气的性质选取尾气处理装置;
(2)根据过氧化钠的性质分析;
(3)从原料的利用率、成本、过氧化钠的性质及生成气体的性质来分析;
(4)用过氧化钠和浓盐酸反应制取的气体成分及分离的难易程度分析.
解答 解:I.①在加热条件下,二氧化锰与浓盐酸反应生成氯化锰、氯气和水,其反应的离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
②过氧化钠有强氧化性能把浓盐酸氧化生成氯气,同时自身被还原生成水,结合原子守恒写出其反应方程式为:Na2O2+4HCl=2NaCl+Cl2↑+2H2O,
故答案为:Na2O2+4HCl=2NaCl+Cl2↑+2H2O;
II.(1)用过氧化钠和浓盐酸制取氯气,反应物状态是固液混合,所以盛放液体用分液漏斗,易控制流量,浓盐酸挥发性较强,所以要采用密封装置,防止其挥发,利用产生气体的压强时盐酸流下,所以反应装置选④⑥;
浓盐酸具有挥发性,所以产生的气体中含有氯化氢,用饱和食盐水洗气,为防止洗气瓶内压强过大,应有一个缓冲装置,故选⑤;
用淀粉碘化钾溶液检验氯气,故选⑧;
氯气有毒不能直接排空,应该用氢氧化钠溶液吸收尾气,且尾气量较少,不需要缓冲装置即可,故选①,
故答案为:D;
(2)过氧化钠极易和水反应生成氧气,过氧化钠也能把浓盐酸氧化生成氯气,自身发生氧化还原反应生成氧气,所以制取的气体中可能含有氧气,反应方程式为:2Na2O2+2H2O=4NaOH+O2↑(或4Na2O2+4HCl=4NaCl+2H2O+O2↑),
故答案为:2Na2O2+2H2O=4NaOH+O2↑(或4Na2O2+4HCl=4NaCl+2H2O+O2↑);
(3)从原料的利用率、成本、过氧化钠的性质及生成气体的性质来来考虑,所以其理由是:①Na2O2能与水反应,会使原料的利用率降低; ②双氧水比Na2O2更经济;③产生等量的Cl2,用双氧水消耗的盐酸的量少;④Na2O2能与水反应,生成的NaOH能与盐酸反应;⑤Na2O2能与水反应,生成的NaOH吸收了Cl2,
故答案为:①Na2O2能与水反应,会使原料的利用率降低; ②双氧水比Na2O2更经济;③产生等量的Cl2,用双氧水消耗的盐酸的量少;④Na2O2能与水反应,生成的NaOH能与盐酸反应;⑤Na2O2能与水反应,生成的NaOH吸收了Cl2;
(4)过氧化钠具有强氧化性,能把浓盐酸氧化生成氯气,自身被还原生成氧气,且过氧化钠和水反应也生成氧气,氯气和氧气混合后不易分离,所以得不到较纯净的氯气,
故答案为:否;产物不纯且难以分离.
点评 本题考查性质实验方案设计,要根据物质的性质来设计实验,注意把握过氧化钠的性质,设计实验时要遵循“可行性、科学性、经济性、环保性”规律,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 201.4 g | B. | 212.0 g | C. | 21.2 g | D. | 100.7 g |
| A. |  能作为SO2的干燥装置 | |
| B. |  验证铁钉的吸氧腐蚀 | |
| C. |  可用于测量Cu与浓硝酸反应生成NO2的体积 | |
| D. |  可证明酸性:H2SO4>H2CO3>H2SiO3 |
| A. | 3d | B. | 2p | C. | 5f | D. | 4s |
| A. | 1.00molNaCl固体中含有6.02×1023个NaCl分子 | |
| B. | 46gNO2和N2O4混合气体中含有原子总数为3NA | |
| C. | 1molFe2+与足量的H2O2溶液反应,转移2NA个电子 | |
| D. | 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
| A. | H+、Fe2+、MnO4-、SO42- | B. | Ca2+、H+、SO42-、HCO3- | ||
| C. | Na+、Cu2+、Cl-、OH- | D. | Fe3+、K+、SCN-、Cl- |
| A. | 石油分馏 | B. | 煤干馏 | ||
| C. | 淀粉在人体内消化 | D. | 石油裂解 |
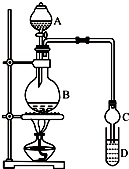 乙酸乙酯是一种用途广泛的精细化工产品.某课外小组设计实验室制取并提纯乙酸乙酯的方案如下:已知:
乙酸乙酯是一种用途广泛的精细化工产品.某课外小组设计实验室制取并提纯乙酸乙酯的方案如下:已知: CH3COOC2H5+H2O.
CH3COOC2H5+H2O.