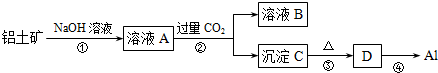
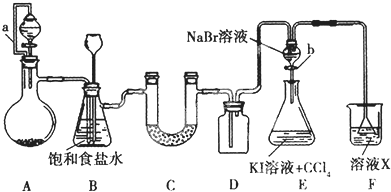
题目内容
2.填写下表:| 分子或离子 | SO3 | SO2 | ClO3- | HCN | NF3 | NO3- |
| 中心原子孤电子对数 | 0 | 1 | 1 | 0 | 1 | 0 |
| σ键电子对数 | 3 | 2 | 3 | 2 | 3 | 3 |
| 中心原子的杂化轨道类型 | Sp2 | Sp2 | Sp3 | Sp | Sp3 | Sp2 |
| VSEPR模型名称 | 平面三角形 | V形 | 四面体 | 直线形 | 四面体 | 平面三角形 |
| 分子或离子立体构型名称 | 平面三角形 | V形 | 三角锥 | 直线形 | 三角锥 | 平面三角形 |
分析 根据价层电子对互斥理论确定分子或离子空间构型,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数.根据n值判断杂化类型:一般有如下规律:当n=2,sp杂化;n=3,sp2杂化;n=4,sp3杂化;中心原子的杂化类型为sp2,说明该分子中心原子的价层电子对个数是3,无孤电子对数,空间构型是平面三角形;单键中只有σ键,双键中有一个σ键和一个π 键,三键中有一个σ键和两个π 键,据此分析解答.
解答 解:SO3 分子中价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(6-3×2)=3,所以硫原子采用sp2杂化,无孤电子对数,VSEPR模型、分子立体构型都为平面三角形,
SO2中S原子和氧原子形成2个σ键,孤电子对个数=$\frac{1}{2}$×(6-2×2)=1,价层电子对数为=2+1=3,为sp2杂化,VSEPR模型为四面体,含1对孤电子对,分子立体构型为V形,
ClO3-中价层电子对个数=3+$\frac{1}{2}$(7+1-3×2)=4,σ键电子对数为3,中心原子孤电子对数为1,所以氯原子采用sp3杂化,VSEPR模型为四面体,且含有一个孤电子对,所以离子立体构型为三角锥形;
HCN分子的结构式是:H-C≡N,HCN分子中含有2个σ键和2个π键,C原子不含孤电子对,所以价层电子对数是2,中心原子C原子以sp杂化轨道成键,VSEPR模型、分子立体构型都为直线形,
NF3中N原子形成3个σ键,孤对电子数为$\frac{5-3×1}{2}$=1,则为sp3杂化,VSEPR模型为四面体,且含有一个孤电子对,所以离子立体构型为三角锥形,
NO3-中N原子的价层电子对数为$\frac{5+1}{2}$=3,则为sp3杂化,没有孤电子对,所以NO3-的VSEPR模型、离子立体构型为平面三角形,
故答案为:
| 分子或离子 | SO3 | SO2 | ClO3- | HCN | NF3 | NO3- |
| 中心原子孤电子对数 | 0 | 1 | 1 | 0 | 1 | 0 |
| σ键电子对数 | 3 | 2 | 3 | 2 | 3 | 3 |
| 中心原子的杂化轨道类型 | Sp2 | Sp2 | Sp3 | Sp | Sp3 | Sp2 |
| VSEPR模型名称 | 平面三角形 | V形 | 四面体 | 直线形 | 四面体 | 平面三角形 |
| 分子或离子立体构型名称 | 平面三角形 | V形 | 三角锥 | 直线形 | 三角锥 | 平面三角形 |
点评 本题考查了原子杂化方式及分子或离子的立体构型的判断,侧重分子或离子结构与性质的考查,注意杂化轨道理论的理解应用,把握常见分子或离子中原子的杂化及空间构型为解答的关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 201.4 g | B. | 212.0 g | C. | 21.2 g | D. | 100.7 g |
| A. | H+、Fe2+、MnO4-、SO42- | B. | Ca2+、H+、SO42-、HCO3- | ||
| C. | Na+、Cu2+、Cl-、OH- | D. | Fe3+、K+、SCN-、Cl- |
| A. | 石油分馏 | B. | 煤干馏 | ||
| C. | 淀粉在人体内消化 | D. | 石油裂解 |
| A. | 用无水硫酸铜检验乙醇中是否含水 | |
| B. | 用溴水检验汽油中是否含有不饱和脂肪烃 | |
| C. | 用蒸馏的方法可以分离醋酸与乙醇的混合物 | |
| D. | 检验某卤代烃中是否含溴:加入NaOH溶液,加热,冷却,再加入硝酸银溶液 |
| A. | 氢氧化钙固体与氯化铵固体的反应 | B. | 氨气和氯化氢化合 | ||
| C. | 甲烷与氧气的反应 | D. | 石灰石的分解反应 |